题目内容
根据下表信息,下列判断正确的是( )
| 酸 | 电离常数(常温下) |
| CH3COOH | Ki=1.8×10-5 |
| H2CO3 | Ki1=4.3×l0-7,Ki2=5.6×10-11 |
| H2S | Ki1=9.1×10-8,Ki2=1.1×10-12 |
| A、0.10mol/L的下列各溶液pH:Na2S<Na2CO3 |
| B、HCO3-+CH3COOH→H2O+CO2↑+CH3COO- |
| C、硫化钠溶液可以与碳酸氢钠溶液反应 |
| D、pH相同的CH3COOH、H2CO3、H2S,溶液浓度依次减小 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答.
解答:
解:根据电离平衡常数知,酸性强弱顺序为:CH3COOH>H2CO3>H2S>HCO3->HS-,
A、酸性越强,其对应盐的水解程度越弱,即碱性越弱,由于酸性HCO3->HS-,故碱性:Na2S>Na2CO3,故A错误;
B、乙酸的酸性大于碳酸和碳酸氢根,所以CH3COOH+HCO3-→CH3COO-+H2O+CO2↑能发生,故B正确;
C、由于酸性:HCO3->HS-,故硫化钠溶液可以与碳酸氢钠溶液反应生成NaHS和碳酸钠,故C正确;
D、酸性越强,其pH值越小,由于酸性CH3COOH>H2CO3>H2S,故pHCH3COOH<H2CO3<H2S,故D错误;
故选BC.
A、酸性越强,其对应盐的水解程度越弱,即碱性越弱,由于酸性HCO3->HS-,故碱性:Na2S>Na2CO3,故A错误;
B、乙酸的酸性大于碳酸和碳酸氢根,所以CH3COOH+HCO3-→CH3COO-+H2O+CO2↑能发生,故B正确;
C、由于酸性:HCO3->HS-,故硫化钠溶液可以与碳酸氢钠溶液反应生成NaHS和碳酸钠,故C正确;
D、酸性越强,其pH值越小,由于酸性CH3COOH>H2CO3>H2S,故pHCH3COOH<H2CO3<H2S,故D错误;
故选BC.
点评:本题考查弱电解质的电离,根据平衡常数确定酸性强弱,从而确定酸之间的转化,结合电荷守恒来分析解答,难度中等.

练习册系列答案
相关题目
某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是( )


| A、根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B、沉淀H为Al(OH)3、BaCO3的混合物 |
| C、溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D、若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol?L-1 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、能溶解Al2O3的溶液:Na+、K+、Cl-、SiO32- |
| C、无色透明溶液中:Al3+、Cu2+、Cl-、HCO3- |
| D、使甲基橙变红色的溶液:Mg2+、K+、Cl-、SO42- |
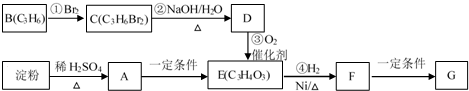
 ,经测定,C谱有四个峰,其数值高低比例为2:1:1:1;H谱有四个峰,其数值高低比例为1:2:3:6,有机物A碳谱有两个峰,峰高比为4:1,氢谱有一个峰,试写出有机物A的结构简式
,经测定,C谱有四个峰,其数值高低比例为2:1:1:1;H谱有四个峰,其数值高低比例为1:2:3:6,有机物A碳谱有两个峰,峰高比为4:1,氢谱有一个峰,试写出有机物A的结构简式
