题目内容
在1~18号元素中,除稀有气体元素外:
(1)原子半径最大的元素是 ,原子半径最小的元素是 .
(2)单质的还原性最强的元素是 ,单质的氧化性最强的元素是 .
(3)形成化合物种类最多的元素是 .
(1)原子半径最大的元素是
(2)单质的还原性最强的元素是
(3)形成化合物种类最多的元素是
考点:元素周期表的结构及其应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:根据元素周期律的递变规律判断,元素周期表中,同一周期元素从左到右元素的原子半径逐渐减小,元素的金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱,以此解答该题.
解答:
解:(1)同一周期元素从左到右元素的原子半径逐渐减小,同主族元素从上到下元素的原子半径逐渐增大,可知原子半径最大的是Na,最小的为H,
故答案为:Na;H;
(2)同一周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的金属性逐渐增强,非金属性逐渐减弱,且元素的非金属性越强,对应的单质的氧化性越强,元素的金属性越强,对应的单质的还原性越强,可知单质的还原性最强的为Na;单质的氧化性最强的元素是F,
故答案为:Na;F;
(3)形成化合物种类最多的元素是C,可形成有机物,故答案为:C.
故答案为:Na;H;
(2)同一周期元素从左到右元素的金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下元素的金属性逐渐增强,非金属性逐渐减弱,且元素的非金属性越强,对应的单质的氧化性越强,元素的金属性越强,对应的单质的还原性越强,可知单质的还原性最强的为Na;单质的氧化性最强的元素是F,
故答案为:Na;F;
(3)形成化合物种类最多的元素是C,可形成有机物,故答案为:C.
点评:本题考查元素周期表和元素周期律知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
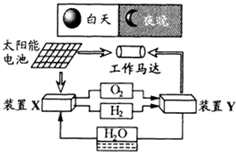 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )| A、二氧化硅是太阳能电池的光电转换材料 |
| B、装置Y中正极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的氢气和氧气再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
下列有关电池叙述正确的是( )
| A、化学电池的反应本质是复分解反应 |
| B、铅蓄电池放电时,是电能转变为化学能的过程 |
| C、锌锰干电池碳棒是负极,锌片是正极 |
| D、锌锰干电池工作一段时间后锌外壳逐渐变薄 |
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
| A、2Na218O2+2H2O=4Na18OH+O2↑ |
| B、NH4Cl+2H2O?NH32?H2O+HCl |
| C、C2H518OH+CH3COOH?CH3CO18OC2H5+H2O |
| D、K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O |
下列化学式只表示一种分子的是( )
| A、C2H6O |
| B、(C6H10O5)n |
| C、-CH2CH3 |
| D、C2H4 |
若NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1mol Na2O2与水反应时,转移电子的数目为2NA |
| B、标准状况下,22.4L水中含有水分子的数目为NA |
| C、14g N2中含有电子的数目为7NA |
| D、数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |