题目内容
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2.有关它们的叙述:
①与水反应都是氧化还原反应;
②与水反应后的溶液都显碱性;
③与盐酸反应都只生成一种盐;
④两种化合物中的阴阳离子均具有相同的电子层结构.其中正确的是( )
①与水反应都是氧化还原反应;
②与水反应后的溶液都显碱性;
③与盐酸反应都只生成一种盐;
④两种化合物中的阴阳离子均具有相同的电子层结构.其中正确的是( )
| A、①②③④ | B、①②③ |
| C、②③ | D、② |
考点:钠的重要化合物,氧化还原反应
专题:
分析:①根据元素化合价是否发生变化判断;
②强碱和弱碱在水溶液中都为碱性;
③Na3N与盐酸反应生成氯化钠与氯化铵;
④Na3N和NaH的阳离子电子结构相同,阴离子结构不相同.
②强碱和弱碱在水溶液中都为碱性;
③Na3N与盐酸反应生成氯化钠与氯化铵;
④Na3N和NaH的阳离子电子结构相同,阴离子结构不相同.
解答:
解:①反应①中元素化合价都没有发生变化,不是氧化还原反应,故①错误;
②反应①有氢氧化钠和氨气生成,故溶液显碱性,反应②有氢氧化钠生成,故溶液显碱性,故②正确;
④Na3N与与盐酸反应生成氯化钠和氯化铵两种盐,故③错误;
④Na3N和NaH的阳离子电子结构相同,阴离子结构不相同,氮负离子有2个电子层,氢负离子只有1个电子层,故④错误;
故选D.
②反应①有氢氧化钠和氨气生成,故溶液显碱性,反应②有氢氧化钠生成,故溶液显碱性,故②正确;
④Na3N与与盐酸反应生成氯化钠和氯化铵两种盐,故③错误;
④Na3N和NaH的阳离子电子结构相同,阴离子结构不相同,氮负离子有2个电子层,氢负离子只有1个电子层,故④错误;
故选D.
点评:本题考查了钠及其化合物的性质,涉及氧化还原反应的判断、原子结构的判断,题目难度不大,把握氧化还原反应的规律,准确判断元素的化合价是解题关键.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
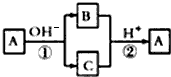

| A、X元素一定为非金属元素 |
| B、X元素可能为Al |
| C、反应①和②互为可逆反应 |
| D、反应①和②可能为氧化还原反应 |
从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是( )


| A、实验室在蒸发皿中灼烧干海带,并且用玻璃搅拌 |
| B、含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 |
| C、在碘水中加入几滴淀粉溶液,溶液变蓝色 |
| D、碘水中加入CCl4得到I2的CCl4的溶液,该操作为“萃取” |
100mL浓度为2mol?L-1的盐酸溶液跟过量的锌片反应,为减慢反应速率,又不影响生成H2的总量,可采用的方法有( )
| A、加适量6mol?L-1HCl溶液 |
| B、加数滴CuCl2溶液 |
| C、加适量醋酸钠固体 |
| D、加适量NaNO3溶液 |
下列物质必须隔绝空气保存的是( )
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3 ⑥NaCl.
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3 ⑥NaCl.
| A、①② | B、②③④⑤ |
| C、①②③④ | D、①②③④⑤ |
“纳米材料”是直径从几纳米至几十纳米的材料.如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是( )
| A、所得分散系极不稳定 |
| B、具有丁达尔效应 |
| C、不能透过滤纸 |
| D、以上性质都不具有 |
常温下,以下4种溶液pH最小的是( )
| A、0.01mol?L-1醋酸溶液 |
| B、0.02mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| C、0.03mol?L-1醋酸与0.01mol?L-1NaOH溶液等体积混合液 |
| D、pH=2的盐酸与pH=12NaOH溶液等体积混合液 |
下列有关物质性质的说法错误的是( )
| A、热稳定性:HCl>HI |
| B、原子半径:Na>Mg |
| C、酸性:H2SO3>H2SO4 |
| D、还原性:S2->Cl- |
 、⑤ClCH=CHCl、⑥
、⑤ClCH=CHCl、⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨
、⑨