题目内容
短周期主族元素W、R、X、Y、Z的原子序数依次增大,且分别占三个不同的周期.W与X同主族,R与Z同主族,R最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素.下列说法正确的是( )
| A、W、X是金属元素 |
| B、简单气态氢化物的热稳定性:Z>R |
| C、原子半径:R<Y<Z |
| D、X、Y、Z的最高价氧化物对应的水化物能相互反应 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期主族元素W、R、X、Y、Z的原子序数依次增大,且分别占有三个不同的周期,则W应为H元素;
R最外层电子数是其内层电子数的3倍,原子核外应有2个电子层,最外层电子数为6,应为O元素;
R与Z同主族,Z应为S元素;W与X同主族,X应为Na元素;
Y是地壳中含量最多的金属元素,应为Al元素,以此解答该题.
R最外层电子数是其内层电子数的3倍,原子核外应有2个电子层,最外层电子数为6,应为O元素;
R与Z同主族,Z应为S元素;W与X同主族,X应为Na元素;
Y是地壳中含量最多的金属元素,应为Al元素,以此解答该题.
解答:
解:短周期主族元素W、R、X、Y、Z的原子序数依次增大,且分别占有三个不同的周期,则W应为H元素,R最外层电子数是其内层电子数的3倍,原子核外应有2个电子层,最外层电子数为6,应为O元素,R与Z同主族,Z应为S元素,W与X同主族,X应为Na元素,Y是地壳中含量最多的金属元素,应为Al元素,
A.根据以上分析可知W为H元素,属于非金属,故A错误;
B.Z为S、R为O,非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,则简单气态氢化物的热稳定性:Z<R,故B错误;
C.R为O、Y为Al、Z为S元素,电子层越多,比较越大,电子层相同时,原子序数越大,原子半径越小,则原子半径:Y>Z>R,故C错误;
D.X、Y、Z的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝和硫酸,氢氧化铝具有两性,可与酸、强碱反应,故D正确;
故选D.
A.根据以上分析可知W为H元素,属于非金属,故A错误;
B.Z为S、R为O,非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,则简单气态氢化物的热稳定性:Z<R,故B错误;
C.R为O、Y为Al、Z为S元素,电子层越多,比较越大,电子层相同时,原子序数越大,原子半径越小,则原子半径:Y>Z>R,故C错误;
D.X、Y、Z的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝和硫酸,氢氧化铝具有两性,可与酸、强碱反应,故D正确;
故选D.
点评:本题考查了元素位置结构性质的判断,题目难度不大,熟悉元素周期表结构是解本题关键,根据原子结构来推断元素,再结合物质的结构、性质来分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在恒压条件下化学反应:2SO2(g)+O2(g)?2SO3(g);△H=-QkJ?mol-1在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:根据以上数据,下列叙述正确的是( )
| 容器 | SO2(mol) | O2(mol) | SO3(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2 |
| 丙 | 0 | 0 | 2 | 0 | Q3 |
| 丁 | 1 | 0.5 | 0 | 1 | Q4 |
| A、平衡时,向甲容器中再加1mol O2,一段时间后达平衡时 O2的体积分数减小 |
| B、平衡时,升高丙容器温度,正反应速率增大,逆反应速率减小,平衡逆向移动 |
| C、各容器中反应放出热量的关系为:Q1=2Q2>2Q4,且Q1+Q3=Q |
| D、丁容器中反应达到平衡时,其化学平衡常数小于乙容器中反应的平衡常数 |

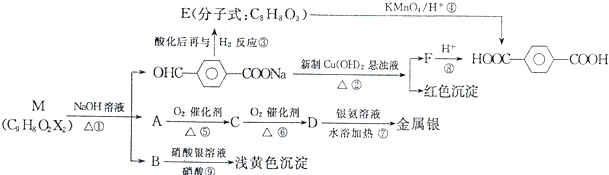
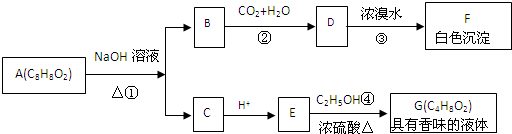

 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E(C4H8O2)是具有果香气味的液体.A、B、C、D在一定条件下有如下转化关系(部分反应条件、产物被省略)
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E(C4H8O2)是具有果香气味的液体.A、B、C、D在一定条件下有如下转化关系(部分反应条件、产物被省略)