题目内容
(9分)砷(As)广泛分布与自然界,砷与氮同主族,比氮多两个电子层。
(1)砷位于元素周期表中_____周期________族,其气态氢化物的稳定性比NH3_______(填“强”或“弱”);
(2)砷的常见酸性氧化物有As2O3和As2O5,请根据图中信息写出As2O3分解为As2O5的热化学方程式:________________________;

(3)已知:将酸滴入砷酸盐与KI混合的溶液中发生反应:AsO43-+2I―+2H+=AsO33-+I2+H2O.某研究性学习小组同学欲利用该反应原理,设计实验装置探究原电池原理,请你配合他们绘制原电池装置图,并回答下列问题:
若以石墨为电极,正极上发生的反应为______________.该电池工作时,当外电路中转移5mol电子时,则有_________molI2生成.
(1)四 VA 弱 (2)As2O5(s)=As2O3(s)+O2(g) △H=+295.4kJ/mol (2分)
(3)绘图(2分) AsO43-+2e-+2H+=AsO33-+H2O(1分) 2.5(1分)

【解析】
试题分析:(1)砷位于元素周期表中位于第四周期第VA主族;由于其非金属性比N弱,所以气态氢化物的稳定性比NH3弱;(2)根据物质的能量及变化过程可得As2O3分解为As2O5的热化学方程式是:As2O5(s)=As2O3(s)+O2(g) △H=+295.4kJ/mol;(3)在原电池反应中在负极上发生氧化反应,在正极上发生还原反应。由于AsO43-被还原为AsO33-,所以应该在正极上发生,在负极上则应该是I―氧化为I2,所以若以石墨为电极,正极上发生的反应为AsO43-+2e-+2H+=AsO33-+H2O;当该电池工作时,当外电路中转移5mol电子时,根据整个闭合回路中电子转移数目相等可知应该有2.5molI2生成.该原电池装置图是 。
。
考点:考查元素在周期表中的位置、热化学方程式的书写、原电池反应原理的利用、设计及电极反应。

 阅读快车系列答案
阅读快车系列答案 、NO
、NO 生成,则原溶液中一定含有_______,可能含有大量的________。
生成,则原溶液中一定含有_______,可能含有大量的________。




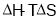 说法中正确的是( )
说法中正确的是( )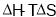 只用于判断温度、体积一定的反应能否自发进行
只用于判断温度、体积一定的反应能否自发进行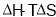 只用于判断温度、压强一定的反应能否自发进行
只用于判断温度、压强一定的反应能否自发进行 H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)