题目内容
目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O
2Ni(OH)2+Cd(OH)2已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能.
| 放电 |
| 充电 |
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能.
| A、①③ | B、②④ | C、①④ | D、②③ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:①两个反应方向的条件不同,充电是电解池,放电是原电池;
②以上反应不是可逆反应,两个反应方向的条件不同;
③充电时,充电是电解池,电能转化为化学能;
④放电是原电池,化学能转变为电能.
②以上反应不是可逆反应,两个反应方向的条件不同;
③充电时,充电是电解池,电能转化为化学能;
④放电是原电池,化学能转变为电能.
解答:
解:①以上反应是可逆反应,两个反应方向的条件不同,充电是电解池,放电是原电池,故不选;
②以上反应不是可逆反应,两个反应方向的条件不同,故选;
③充电时,充电是电解池,电能转化为化学能,故不选;
④放电是原电池,化学能转变为电能,故选;
所以选②④,
故选B.
②以上反应不是可逆反应,两个反应方向的条件不同,故选;
③充电时,充电是电解池,电能转化为化学能,故不选;
④放电是原电池,化学能转变为电能,故选;
所以选②④,
故选B.
点评:本题是考查化学反应的基本概念,原电池、电解池的原理分析判断,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验操作不正确的是( )
A、 蒸发食盐水 |
B、 取固体粉末 |
C、 加热液体 |
D、 倾倒液体 |
下列说法正确的是( )
| A、反应A(g)?2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 | ||
| B、标准状态下,将0.1 mol?L-1 的氨水溶液中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) | ||
| C、足量的锌铜合金与100mL pH=1 稀硫酸反应,反应3s 时测得pH=2,假设反应前后溶液的体积保持不变,则3s 内产生氢气的平均速率是33.6 mL?s-1 | ||
D、将浓度为0.1mol?L-1HF 溶液加水不断稀释过程中,电离度(α)和Ka(HF)保持不变,
|
下表是3种物质的溶解度(20℃),下列说法中正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.000 84 | 0.01 |
| A、已知MgCO3的Ksp=6.82×10-6 mol2?L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 mol2?L-2 |
| B、除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液 |
| C、将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 |
| D、用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O |
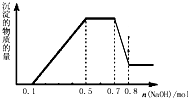 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
| C、溶液中的阳离子只有H+、Mg2+、Al3+ |
| D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、Z的说法正确的是( )


| A、相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B、Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
| C、ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D、由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
我们生活在千变万化的物质世界里.下列过程或变化中,没有发生氧化还原反应的是( )
| A、iPhone5手机电池充电 |
| B、铁制品镀铜 |
| C、爆竹爆炸 |
| D、利用焰色反应检验Na+ |
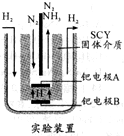 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.