题目内容
20.取50.0mL Na2CO3和Na2SO4的混合溶液,加入过量溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出.(1)用稀硝酸处理后的不溶物为BaSO4(填化学式),写出整个过程中所发生反应的离子方程式:CO32-+Ba2+═BaCO3↓;、SO42-+Ba2+=BaSO4↓、BaCO3+2H+=Ba2++H2O+CO2↑.
(2)原混合溶液中Na2CO3和Na2SO4的物质的量浓度分别是1mol/L、0.4mol/L.
(3)产生的气体在标准状况下的体积为1.12L.
分析 (1)硫酸钡不溶于稀硝酸,则不溶物为BaSO4;碳酸钠与氯化钡反应生成碳酸钡沉淀,CO32-+Ba2+═BaCO3↓;硫酸钠与氯化钡反应生成硫酸钡沉淀:SO42-+Ba2+=BaSO4↓;碳酸钡与稀硝酸反应生成硝酸钡、二氧化碳气体和水:BaCO3+2H+=Ba2++H2O+CO2↑;
(2)碳酸钡能够溶于稀硝酸,硫酸钡不溶,依据质量守恒得:n(Na2SO4)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,根据c=$\frac{n}{V}$计算出硫酸钠的浓度;
碳酸钡的质量为:14.51g-4.66g=9.85g,碳酸钡的物质的量为:$\frac{9.85g}{197g/mol}$=0.05mol,根据质量守恒可知:n(Na2CO3)=n(BaCO3)=0.05mol,根据c=$\frac{n}{V}$计算出碳酸钠的物质的量浓度;
(3)根据(2)可知生成碳酸钡沉淀的物质的量为0.05mol,根据反应BaCO3+2HNO3══Ba(NO3)2+CO2↑+H2O可知生成二氧化碳的物质的量为0.05mol,然后根据V=nVm计算出生成二氧化碳的体积.
解答 解:(1)碳酸钡溶于稀硝酸,而硫酸钡不溶,则不溶物为BaSO4;
碳酸钠与氯化钡反应生成碳酸钡沉淀,反应的化学方程式为:BaCl2+Na2CO3═BaCO3↓+2NaCl,离子方程式为:CO32-+Ba2+═BaCO3↓;
硫酸钠与氯化钡反应生成硫酸钡沉淀,反应的化学方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl,离子方程式为:SO42-+Ba2+=BaSO4↓;
碳酸钡与稀硝酸反应生成硝酸钡、二氧化碳气体和水,反应的离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑,
故答案为:BaSO4;CO32-+Ba2+═BaCO3↓;SO42-+Ba2+=BaSO4↓;BaCO3+2H+=Ba2++H2O+CO2↑;
(2)碳酸钡能够溶于稀硝酸,硫酸钡不溶,依据质量守恒得:n(Na2SO4)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol,所以硫酸钠的物质的量浓度为:c(Na2SO4)=$\frac{0.02mol}{0.05L}$=0.4mol/L;
碳酸钡的质量为:14.51g-4.66g=9.85g,碳酸钡的物质的量为:$\frac{9.85g}{197g/mol}$=0.05mol,根据质量守恒可知:n(Na2CO3)=n(BaCO3)=0.05mol,则碳酸钠的物质的量浓度为:c(Na2CO3)=$\frac{0.05mol}{0.05L}$=1mol/L,
故答案为:1mol/L;0.4mol/L;
(3)根据(2)可知生成碳酸钡沉淀的物质的量为0.05mol,根据反应BaCO3+2HNO3══Ba(NO3)2+CO2↑+H2O可知生成二氧化碳的物质的量为0.05mol,
标准状况下0.05mol二氧化碳的体积为:22.4L/mol×0.05mol=1.12L,
故答案为:1.12L.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | NaOH | B. | 漂白粉 | C. | 氯水 | D. | 生石灰 |
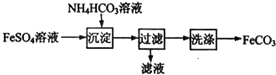
| A. | 过滤操作中所用的玻璃仪器只有烧杯和漏斗 | |
| B. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| C. | 可利用HNO3酸化的BaCl2溶液检验FeSO4溶液中的阴离子 | |
| D. | 沉淀过程中有CO2气体放出 |
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 若反应中转移的电子数可能为$\frac{1}{3}$mol | |
| C. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为7﹕6 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕3 |
| A. | 1.0 mol/L Na2C2O4溶液中:c(OH-)═c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| B. | 含等物质的量的NaHCO3和Na2CO3的溶液中:3c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)] | |
| C. | 二元酸H2A在水中发生电离:H2A=H++HA-和HA-?H++A2-,则NaHA溶液中:c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Cl-)<c(I-) |