题目内容
17.下列说法中正确的是( )| A. | 用电解法精炼铜时粗铜作阴极 | |
| B. | 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 | |
| C. | 化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 | |
| D. | 需要加热的化学反应都是吸热反应 |
分析 A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极;
B.在其他条件不变时,增大压强时如果不改变反应物或生成物浓度,则平衡不移动;
C.化学平衡常数只与温度有关,与其它外界条件无关;
D.化学反应中吸收的能量大于放出的能量,则该反应是吸热反应,但吸热反应不一定需要加热.
解答 解:A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,阳极上Cu和其它比Cu活泼的金属失电子,阴极上铜离子得电子,故A错误;
B.在其他条件不变时,增大压强时如果不改变反应物或生成物浓度,则平衡不移动,且增大压强时对于反应前后气体体积不变的可逆反应平衡也不移动,故B错误
C.化学平衡常数只与温度有关,与其它外界条件无关,如:与浓度、压强等都无关,故C正确;
D.化学反应中吸收的能量大于放出的能量,则该反应是吸热反应,但吸热反应不一定需要加热,如:铝热反应属于放热反应,但开始反应时需要加热,故D错误;
故选C.
点评 本题考查较综合,涉及电解精炼、化学平衡影响因素、反应热等知识点,为高频考点,明确化学反应原理是解本题关键,易错选项是BD,注意B中反应前后气体体积不变的反应,注意D中反应热与反应条件的关系,加热的反应不一定是吸热反应,自发进行的反应也可能是吸热反应,如氯化铵和氢氧化钡的反应,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
7.金属制品是生活中常用物品,根据所学金属知识回答下列问题.
(1)磁铁矿的主要成分是Fe3O4,其中铁元素的化合价为+2、+3.
(2)采用很多方法可以鉴别Fe2+和Fe3+的溶液,下表是其中某些方法,补全下表中所缺的现象.
(3)金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序.他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:
①三种金属的活泼性由强到弱的顺序是Mg、Ti、Cu.
②若铜粉中混有Mg,提纯Cu时可用盐酸(填名称)除去Mg.
③Ti(钛)在化合物中的化合价为+4价,试写出Ti(钛)与盐酸反应的离子方程式Ti+4H+═Ti4++2H2↑.
④冶炼Ti(钛)的反应为TiO2+Cl2+2C═TiCl4+2X,其中X的化学式为CO.
(1)磁铁矿的主要成分是Fe3O4,其中铁元素的化合价为+2、+3.
(2)采用很多方法可以鉴别Fe2+和Fe3+的溶液,下表是其中某些方法,补全下表中所缺的现象.
| 鉴别方法 | Fe2+ | Fe3+ |
| 直接观察色 | 浅绿色 | 棕黄色 |
| 与KSCN溶液 | 无现象 | 血红色 |
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
②若铜粉中混有Mg,提纯Cu时可用盐酸(填名称)除去Mg.
③Ti(钛)在化合物中的化合价为+4价,试写出Ti(钛)与盐酸反应的离子方程式Ti+4H+═Ti4++2H2↑.
④冶炼Ti(钛)的反应为TiO2+Cl2+2C═TiCl4+2X,其中X的化学式为CO.
5.欲将蛋白质从水中析出而又不改变它的性质应加入( )
| A. | 甲醛溶液 | B. | 饱和Na2SO4溶液 | C. | CuSO4溶液 | D. | 浓硫酸 |
12.下列反应属于放热反应的是( )
| A. | 破坏生成物全部化学键所需能量小于破坏反应物全部化学键所需能量 | |
| B. | HCO3-+H2O?CO32-+H3O+ | |
| C. | HCO3-+H2O?H2CO3+OH- | |
| D. | CH3COOH+KOH?CH3COOK+H2O |
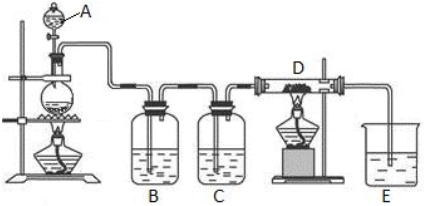
2.下列实验装置或实验方案能达到目的是( )
| A. |  用HF标准溶液测定未知浓度的NaOH溶液 用HF标准溶液测定未知浓度的NaOH溶液 | |
| B. | 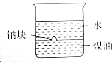 验证密度:ρ(水)<ρ(钠)<ρ(煤油) 验证密度:ρ(水)<ρ(钠)<ρ(煤油) | |
| C. | 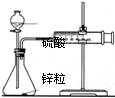 测定锌与硫酸反应的速率 测定锌与硫酸反应的速率 | |
| D. | 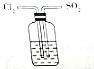 验证SO2和Cl2等物质的量混合增强漂白效果 验证SO2和Cl2等物质的量混合增强漂白效果 |
5.NA代表阿伏伽德罗常数.已知C2H4和C3H6的混合物的质量为m g,则该混合物( )
| A. | 所含碳原子总数为$\frac{m{N}_{A}}{14}$ | |
| B. | 所含碳氢键数目为$\frac{3m{N}_{A}}{14}$ | |
| C. | 所含共用电子对数目为($\frac{m}{14}$+1)NA | |
| D. | 完全燃烧时消耗的O2一定是 $\frac{33.6m}{14}$L |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 一定条件下,1 mol N2与足量H2反应生成NH3,转移电子6NA | |
| C. | pH=13的氢氧化钠溶液中所含Na+为0.1NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
3.下列各组离子能够大量共存且溶液呈无色的是( )
| A. | K+、Na+、Cl-、CO32- | B. | Mg2+、Al3+、OH-、SO42- | ||
| C. | H+、Ag+、Cl-、SO42- | D. | Fe2+、H+、Na+、NO3- |