题目内容
20.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1mol CH3OH(l)完全燃烧生成液态水和CO2,放出725.76kJ的热量.下列热化学方程式书写正确的是( )| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=+725.76 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| C. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1451.52 kJ•mol-1 | |
| D. | 稀HCl与氨水反应生成1 mol H2O所放出的热量为中和热 |
分析 实验测得:101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量,则氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1;1mol CH3OH(l)完全燃烧生成液态水和CO2,放出725.76kJ的热量,则甲醇燃烧的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1;稀的强酸与强碱溶液反应生成1mol水时放出的热量为中和热,据此进行解答.
解答 解:A.甲醇的燃烧为放热反应,焓变值有关小于0,正确的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ•mol-1,故A错误;
B.101kPa时,H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,故B正确;
C.2mol甲醇燃烧生成液态水水放出的热量为1451.52 kJ,该热化学方程式中水的状态不合理,故C错误;
D.氨水为弱碱,电离时吸热,则稀盐酸与氨水反应生成1mol水放出的热量不是中和热,故D错误;
故选B.
点评 本题考查了热化学方程式的书写方法,题目难度不大,明确热化学方程式的书写原则为解答关键,注意掌握燃烧热、中和热的概念及含义,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )


| A. | D在过量的B中燃烧的主要产物为DB3 | |
| B. | C的氢化物的水溶液酸性比E的强 | |
| C. | D与B形成的阴离子可能有DB32-、DB42- | |
| D. | E单质由于分子间形成了氢键,所以很容易液化 |
1.在溶液中能大量共存,若加入OH-有沉淀析出,若加入H+能放出气体的是( )
| A. | Mg2+、Na+、Cl-、CO${\;}_{3}^{2-}$ | B. | Ba2+、K+、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Fe3+、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | D. | Na+、Ca2+、Cl-、HCO${\;}_{3}^{-}$ |
8. 如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录,其中描述合理的组合是( )
如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录,其中描述合理的组合是( )
①Zn为正极,Cu为负极 ②H+向负极移动
③电子是由Zn经外电路流向Cu ④Cu极上有H2产生
⑤若有1mol电子流过导线,则产生的H2为0.5mol
⑥正极的电极反应式为Zn-2e-═Zn2+.
 如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录,其中描述合理的组合是( )
如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录,其中描述合理的组合是( )①Zn为正极,Cu为负极 ②H+向负极移动
③电子是由Zn经外电路流向Cu ④Cu极上有H2产生
⑤若有1mol电子流过导线,则产生的H2为0.5mol
⑥正极的电极反应式为Zn-2e-═Zn2+.
| A. | ①②③ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ②③④ |
15.下列关于乙酸的叙述正确的是( )
| A. | 在发生酯化反应时,乙酸分子羟基中的氢原子跟醇分子中的羟基结合成水 | |
| B. | 乙酸在常温下能与NaOH、Na2CO3、乙醇等发生化学反应 | |
| C. | 乙酸酸性较弱,不能使紫色石蕊变红 | |
| D. | 乙酸分子中既有极性键,又有非极性键 |
10.芘( )的一溴代物有( )
)的一溴代物有( )
 )的一溴代物有( )
)的一溴代物有( )| A. | 3 种 | B. | 4 种 | C. | 5 种 | D. | 6 种 |
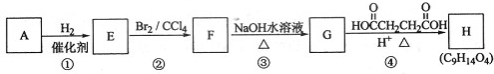
 $\stackrel{KMnO_{4}/H+}{→}$[A]$→_{浓H_{2}SO_{4}/△}^{CH_{3}CH_{2}OH}$[B]$→_{(还原)}^{Fe/H+}$
$\stackrel{KMnO_{4}/H+}{→}$[A]$→_{浓H_{2}SO_{4}/△}^{CH_{3}CH_{2}OH}$[B]$→_{(还原)}^{Fe/H+}$
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$ ②
② $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$
 、B
、B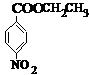 .用1H核磁共振谱可以证明化合物B中有4种氢处于不同的化学环境.
.用1H核磁共振谱可以证明化合物B中有4种氢处于不同的化学环境.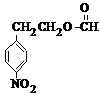 、
、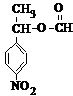 .
.
 .
. $\stackrel{H_{2}O/OH-}{→}$ $\stackrel{H+}{→}$[D]+C2H5OH
$\stackrel{H_{2}O/OH-}{→}$ $\stackrel{H+}{→}$[D]+C2H5OH .
. .
.