题目内容
下列物质中,能与乙酸发生反应的是( )
①石蕊 ②乙醇 ③金属铝 ④氧化镁 ⑤碳酸钙 ⑥氢氧化铜.
①石蕊 ②乙醇 ③金属铝 ④氧化镁 ⑤碳酸钙 ⑥氢氧化铜.
| A、①③④⑤⑥ | B、③④⑤⑥ |
| C、①②④⑤⑥ | D、全部 |
考点:有机物的结构和性质,乙酸的化学性质
专题:有机反应
分析:乙酸含-COOH,具有酸性,能与指示剂、金属、金属氧化物、碱、某些盐发生反应,乙酸与乙醇可发生酯化反应,以此来解答.
解答:
解:①乙酸属于酸,能使石蕊变红,故正确;
②乙醇与乙酸可发生酯化反应生成乙酸乙酯,故正确;
③乙酸可与金属铝反应生成氢气,故正确;
④乙酸与氧化镁反应生成醋酸镁和水,故正确;
⑤乙酸与碳酸钙反应生成醋酸钙和水、二氧化碳,故正确;
⑥乙酸与氢氧化铜反应生成醋酸铜和水,故正确;
故选D.
②乙醇与乙酸可发生酯化反应生成乙酸乙酯,故正确;
③乙酸可与金属铝反应生成氢气,故正确;
④乙酸与氧化镁反应生成醋酸镁和水,故正确;
⑤乙酸与碳酸钙反应生成醋酸钙和水、二氧化碳,故正确;
⑥乙酸与氢氧化铜反应生成醋酸铜和水,故正确;
故选D.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重乙酸性质的考查,注意酸的通性的分析,题目难度不大.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
有四种氯化物,它们的通式为XCl2,其中最可能是第IIA族元素的氯化物是( )
| A、白色固体,熔点低,完全溶于水,得到一种无色中性溶液,此溶液导电性差 |
| B、绿色固体,熔点高,易被氧化,得到一种蓝绿色溶液,此溶液具有良好的导电性 |
| C、白色固体,极易升华,如与水接触,可慢慢分解 |
| D、白色固体,熔点较高,易溶于水,得无色中性溶液,此溶液具有良好的导电性 |
某工业生产经过以下转化步骤:
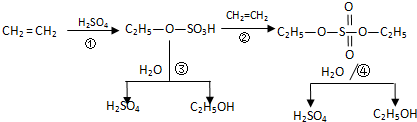
下列说法中不正确的是( )

下列说法中不正确的是( )
| A、该过程中③、④是酯类的水解反应 |
| B、该过程中硫酸是催化剂 |
| C、该过程中①、②是加成反应 |
| D、该过程是一种新的硫酸生产方法 |
室温下,0.1mol?L-1 HF溶液与0.1mol?L-1 NaOH溶液等体积混合(忽略混合前后溶液体积的变化),则下列有关混合后的溶液中离子浓度的叙述正确的是( )
| A、由水电离产生的c(H+)为1.0×10-7mol?L-1 |
| B、c(F-)+c(HF)=c(Na+) |
| C、升高温度,c(F-)增大 |
| D、c(F-)>c(Na+)>c(H+)>c(OH-) |
下列物质所属的类别及其所含官能团的对应关系错误的是( )
A、CH3CH=CH2 烯烃  |
B、 醛类-CHO 醛类-CHO |
C、 羧酸-COOH 羧酸-COOH |
| D、RCH2OH(R,烃基) 醇类-OH |
下列说法正确的是(NA表示阿伏加德罗常数的数值)( )
| A、在常温常压下,11.2 L N2含有的分子数为0.5 NA |
| B、22.4L Cl2所含原子数为2NA |
| C、在常温常压下,1 mol Ne含有的原子数为NA |
| D、在同温同压时,相同体积的任何气体单质所含的原子数相同 |
短周期元素X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为14;X原子的内层电子数与Y原子的最外层电子数相等;X原子的核外电子总数与Z原子的最外层电子数相等.下列说法正确的是( )
| A、X的氧化物都能与水反应生成酸 |
| B、Z的离子半径比Y的离子半径小 |
| C、Y和Z组成的化合物是离子化合物 |
| D、X的气态氢化物分子与Z的离子具有相同的电子数 |
在b L FeBr2溶液中通入a mol Cl2时,使溶液中30%的Br-氧化为Br2,则原FeBr2的物质的量浓度为( )
A、0.25
| ||
B、0.5
| ||
C、1.0
| ||
D、1.25
|