��Ŀ����
����Ŀ���������´��ڷ�Ӧ��H2(g)+I2(g) ![]() 2HI(g) ��H<0.����������ͬ��1L���ݾ���(�����û����������)̬���������ڢ��г���lmolH2��1mol��2(g)���ڢ��г���2molHl(g).�ڢ��г���2molH2��2molI2 (g)��700�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����()
2HI(g) ��H<0.����������ͬ��1L���ݾ���(�����û����������)̬���������ڢ��г���lmolH2��1mol��2(g)���ڢ��г���2molHl(g).�ڢ��г���2molH2��2molI2 (g)��700�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ����()
A. �������з�Ӧ������ͬ
B. �������з�Ӧ��ƽ�ⳣ����ͬ
C. �������е�������ɫ���������е�������ɫdz
D. ��������H2��ת��������������HI��ת��֮��С��1
���𰸡�D
��������
A���������д�����Ӧ��ʼ����ƽ�⣬�������д��淴Ӧ��ʼ���ƽ�⽨����;������ͬ��
B�����������൱������������ƽ��Ļ������ټ���1mol H2��1mol I2��g������Ӧ������Ӧ���У����������е���ƽ��ʱ�¶ȸ��ߣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС��
C�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���
D���¶���ͬʱ����������H2 ��ת��������������HI��ת����֮�͵���1�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���
A���������д�����Ӧ��ʼ����ƽ�⣬�������д��淴Ӧ��ʼ���ƽ�⽨����;������ͬ�����ȽϷ�Ӧ���ʣ�ѡ��A����
B�����������൱������������ƽ��Ļ������ټ���1mol H2��1mol I2��g������Ӧ������Ӧ���У����������е���ƽ��ʱ�¶ȸ��ߣ��÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ���¶�Խ��ƽ�ⳣ��ԽС��ѡ��B����
C�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ������������е�������ɫ���������е�������ɫ�ѡ��C����
D���¶���ͬʱ������I��H2 ��ת��������������HI��ת����֮�͵���1�����������������ƽ��״̬���൱������������ƽ��Ļ����Ͻ����¶ȣ�ƽ��������Ӧ�ƶ���HI��ת���ʱ���������ͬ�¶�ʱ��������HI��ת���ʵͣ�����������H2 ��ת��������������HI��ת����֮��С��1��ѡ��D��ȷ��
��ѡD��

����Ŀ���ⶨ![]() ��Һ�������ٽ��¹����е�
��Һ�������ٽ��¹����е�![]() ���������±���ʵ������У�ȡ�١���ʱ�̵���Һ�����������ữ��
���������±���ʵ������У�ȡ�١���ʱ�̵���Һ�����������ữ��![]() ��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ����˵������ȷ����
��Һ���Ա�ʵ�飬�ܲ�����ɫ�����ࡣ����˵������ȷ����
ʱ�� | �� | �� | �� | �� |
�¶� | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() ��Һ�д���ˮ��ƽ�⣺
��Һ�д���ˮ��ƽ�⣺![]()
B. �ܲ����İ�ɫ������![]()
C. �١��۵Ĺ����У�![]() �ڽ���
�ڽ���
D. �١��۵Ĺ�����,�¶���![]() ��ȣ�ǰ�߶�ˮ��ƽ���Ӱ�����
��ȣ�ǰ�߶�ˮ��ƽ���Ӱ�����
����Ŀ��(1)2017���п�Ժij�о��Ŷ�ͨ�����һ������Na-Fe3O4/HZSM-5��ܸ��ϴ������ɹ�ʵ����CO2ֱ�Ӽ�����ȡ����ֵ���ͣ����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
��֪��H2(g)+1/2O2(g)=H2O(l) ��H1 = ��aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ��H2= ��bKJ/mol
��д��25����101kPa�����£�CO2��H2��Ӧ��������(��C8H18��ʾ)���Ȼ�ѧ����ʽ_________________________________��
(2)����CO2��H2Ϊԭ�ϣ��ں��ʵĴ���(��Cu/ZnO����)�����£�Ҳ�ɺϳ�CH3OH���漰�ķ�Ӧ�У�
�ף�CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H= �� 53.7kJ��mol-1 ƽ�ⳣ��K1
CH3OH(g)+H2O(g) ��H= �� 53.7kJ��mol-1 ƽ�ⳣ��K1
�ң�CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H= + 41.2kJ��mol-1 ƽ�ⳣ��K2
CO(g)+H2O(g) ��H= + 41.2kJ��mol-1 ƽ�ⳣ��K2
��CO(g)+2H2(g) ![]() CH3OH(g)��ƽ�ⳣ��K=______(�ú�K1��K2�ı���ʽ��ʾ)���÷�Ӧ��H_____0(��������������С����)��
CH3OH(g)��ƽ�ⳣ��K=______(�ú�K1��K2�ı���ʽ��ʾ)���÷�Ӧ��H_____0(��������������С����)��
�����CO2ת��ΪCH3OHƽ��ת���ʵĴ�ʩ��___________(��д����)��
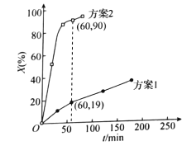
�۴����ͷ�Ӧ��ϵ�Ĺ�ϵ��������Կ�Ĺ�ϵһ�������и߶ȵ�ѡ���ԡ���������ʵ�飬����CO2��H2��ʼͶ�ϱȾ�Ϊ1��2.2��������ͬ��Ӧʱ��(t1min)��
�¶�(K) | ���� | CO2ת����(%) | �״�ѡ����(%) | �ۺ�ѡ�� |
543 | Cu/ZnO���װ����� | 12.3 | 42.3 | A |
543 | Cu/ZnO����Ƭ���� | 11.9 | 72.7 | B |
553 | Cu/ZnO���װ����� | 15.3 | 39.1 | C |
553 | Cu/ZnO����Ƭ���� | 12.0 | 70.6 | D |
�ɱ����е����ݿ�֪����ͬ�¶��²�ͬ�Ĵ�����CO2��ת��ΪCH3OH��ѡ����������Ӱ�죬�����ϱ��������ݽ�Ϸ�Ӧԭ������������ѡ��Ϊ___________(����ĸ����)��
(3)��CO��H2Ϊԭ�Ϻϳ��״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g)���������Ϊ2L�����������ܱ����������������У��ֱ���1molCO��2molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣��ͼΪ���������еķ�Ӧ�����е�5minʱH2���������ʾ��ͼ��������һ��������Ӧһ���ﵽƽ��״̬��
CH3OH(g)���������Ϊ2L�����������ܱ����������������У��ֱ���1molCO��2molH2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣��ͼΪ���������еķ�Ӧ�����е�5minʱH2���������ʾ��ͼ��������һ��������Ӧһ���ﵽƽ��״̬��
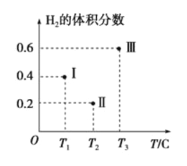
��0��5minʱ��������������CH3OH��ʾ�Ļ�ѧ��Ӧ����Ϊ_________________��
������������һ���ﵽƽ��״̬��������________(��д��������)��