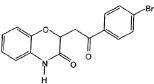
��Ŀ����
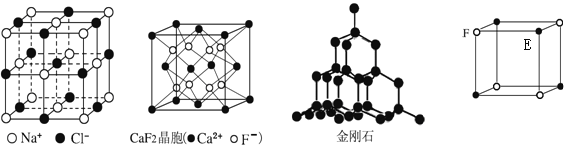
����Ŀ��X��Y��Z��R��W��ԭ���������ε��������ֶ���������Ԫ�أ���������������֮��Ϊ11������YԪ���������ͻ��ϼ۵Ĵ�����Ϊ2��Y��Z�ĵ������ɵĻ�������һ�ִ�������Ϣ�ġ���ʹ���ӡ���R��ԭ�Ӱ뾶������Ԫ�������ģ�Y��W��ͬ��Ԫ�ء�����˵��������ǣ� ��
A. �����ӵĻ�ԭ�ԣ�Y>Z
B. R�ĵ��ʿ����ǽ�����ǽ���
C. ��X��Z��W���ɵ���һ������Ԫ��
D. ��״���£�1molYZ��0.5mol![]() ��Ϻ�������������һ��С��22.4L
��Ϻ�������������һ��С��22.4L
���𰸡�C
��������
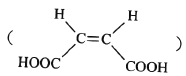
YԪ��ΪNԪ�أ�WԪ��ΪPԪ�أ�����ʹ������ΪNO����ZԪ��ΪOԪ�أ�R��ԭ�Ӱ뾶������Ԫ�������ģ�����ӦΪ�������ڵ�Na��Mg��Al��Si����XԪ��ΪHԪ�ء�
A. ���Ӱ뾶Խ��Խ��ʧȥ���ӣ����ӻ�ԭ��Խǿ���뾶��![]() ����ԭ�ԣ�
����ԭ�ԣ�![]() ����A��ȷ��
����A��ȷ��
B. R����ΪNa��Mg��Al��Si���ǽ�����ǽ�������B��ȷ��
C. H��O��PҲ���ܹ���һԪ��![]() �ȣ���C����
�ȣ���C����
D. ����2![]() ������1mol NO��0.5mol
������1mol NO��0.5mol![]() ��Ϻ�������������ʵ���С��1mol��������ڱ�״����һ��С��22.4L����D��ȷ��
��Ϻ�������������ʵ���С��1mol��������ڱ�״����һ��С��22.4L����D��ȷ��
��ѡC��

 ��У����ϵ�д�
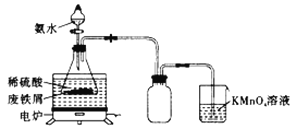
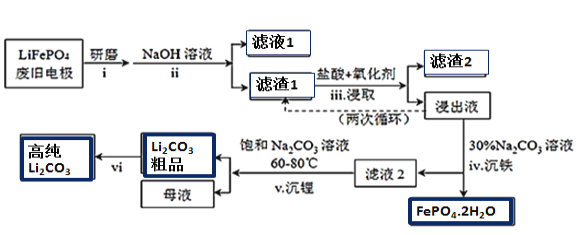
��У����ϵ�д�����Ŀ������Դ�����ĺ��IJ���������ӵ�أ��������������(LiFePO4)���缫���ϡ���LiFePO4�Ͼɵ缫��������Al��ʯī�ۣ����ղ���øߴ�Li2CO3�Ĺ�ҵ������ͼ��
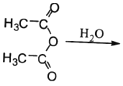
���ϣ�̼�����ˮ���ܽ�����¶ȱ仯���£�
�¶�/�� | 0 | 20 | 40 | 60 | 80 | 100 |
�ܽ��/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
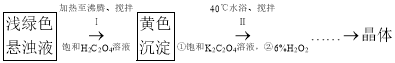
(1)����i��ĥ�����Ŀ����__________________��
(2)����ii��������NaOH��Һ������(�û�ѧ��Ӧ����ʽ��ʾ)_________________��
(3)�����iii����NaClO3��Ϊ��������������лᷴӦ�ᷢ������Ӧ���ɻ���ɫ���壬
���ø���Ӧ��Ӧ�����ӷ���ʽΪ_______________________________________________________��
�ӻ����Ƕȷ�����ѡ��___________(����ĸ)��Ϊ�ù��̵�����������á�
a.H2O2 b.Ũ���� c.ŨHNO3
������iii�õ��Ľ���Һѭ�����ε�Ŀ����________________________________________________��
(4)����Һ�д��ڴ���H2PO4����HPO42-����֪��![]() �����ƽ���ƶ�ԭ����������iv�õ������������ԭ��______________________________________��
�����ƽ���ƶ�ԭ����������iv�õ������������ԭ��______________________________________��
(5)��������vi�IJ���______________________________________________________________��
����Ŀ������Ľ������������ڸ���Ԫ�صľ������롣
��1��������һ���ʳ�������������� 6g��
����ȥ NaCl��Һ�е�SO42-�����μ������ҺΪ�������ʵĻ�ѧʽ��������______��Һ������______��Һ������ϡ���ᡣ
��ʳ�õ�����ʳ���м��� KIO3���±���ij���г������۵�һ�����ӵ�������װ�ϵIJ�������˵�����ش��������⣺
���ϱ� | ���ƺ��Ρ�����أ�KIO3�� |
������ | 20~40 mg/kg |
���ط��� | �ܷ�ܹ⡢���� |
ʳ�÷��� | ���ʱ��ʳƷ��������� |
ʳ�õ�������������ָ______��������������������Ԫ���������Ʋ������أ�KIO3����ѧ���ʣ�����أ�KIO3���ڸ���ʱ______�������ֽ����������ֽ�������һ�ֲⶨ�������Ļ�ѧԭ���ǣ�
������KIO3 + KI + H2SO4===K2SO4 + I2 + H2O��δ��ƽ����
������I2 + 2Na2S2O3 = 2NaI + Na2S4O8������Ӧ �� ��дΪ���ӷ���ʽ_____
��2������ÿ���ʳ������ȡ 0.8 g Ca Ԫ�ء�0.3 g Mg Ԫ�ء�
��Ca Ԫ���� Mg Ԫ�����ʵ���֮��Ϊ______��
��ī��Ƿ�(��Ҫ�ɷ��� CaCO3��������������θ����࣬��ԭ����_________(�����ӷ���ʽ�ش�)��
���Ӻ�ˮ�п���ȡþ����ȥ���� Mg(OH)2 �е� Ca(OH)2 ����ѷ����ǣ����������______������A������B������A. MgSO4 ��Һ��B. MgCl2 ��Һ�������ˣ�ϴ�ӣ����º�ɡ�