题目内容
【题目】研究含N、S的污染排放物并妥善处理和利用,意义重大。回答下列问题:
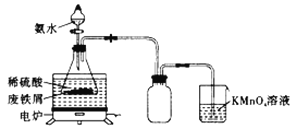
(1)![]() 尾气先用氨水吸收生成
尾气先用氨水吸收生成![]() ,反应为
,反应为![]()
![]() ,再将
,再将![]() 氧化为
氧化为![]() ,最终实现副产氮肥,变废为宝。两种氧化方案如下:
,最终实现副产氮肥,变废为宝。两种氧化方案如下:
方案1:![]()
方案2:![]() ,
,
![]() 。
。
30℃时,分别向两相同容器中加入100L 0.4![]() 溶液,加入足量相同物质的量的氧化剂,测得
溶液,加入足量相同物质的量的氧化剂,测得![]() 的氧化率X(%)随时间的变化如图所示。
的氧化率X(%)随时间的变化如图所示。
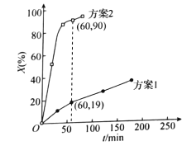
据上述图像判断,氧化![]() 为
为![]() 的能力是
的能力是![]() ____(填“大于”或“小于”)
____(填“大于”或“小于”)![]() ,可能的原因是___。
,可能的原因是___。
②60min内测得方案2体系中用![]() 表示的反应速率为__
表示的反应速率为__![]() 。
。
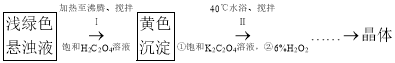
(2)方案2中,![]() 会被氧化成
会被氧化成![]() ,而
,而![]() 不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加
不能结合氧气(活化分子氧),为了保持钴氨溶液的吸收能力,需添加![]() 将
将![]() 还原成
还原成![]() ,同时生成
,同时生成![]() 。反应历程如下:
。反应历程如下:
i:![]()
ii:_____
iii:![]()
iv:![]()
则第ii步反应为____。
(3)利用废气中的![]() 将(2)中生成的
将(2)中生成的![]() 还原成
还原成![]() ,以实现
,以实现![]() 再生。反应的离子方程式为____。
再生。反应的离子方程式为____。
![]() 再生后,实现了利用方案2完整地氧化
再生后,实现了利用方案2完整地氧化![]() 为
为![]() 的过程,则整个过程中起催化剂作用的是___(填离子符号)。
的过程,则整个过程中起催化剂作用的是___(填离子符号)。
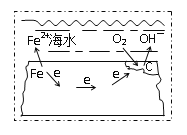
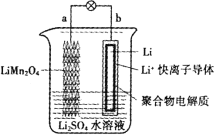
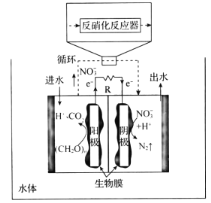
(4)关于微生物电化学系统处理含氮废水的研究快速发展,如图是一种新型的浸没式双极室脱盐-反硝化电池。由阳极室和阴极室组成,中间由质子交换膜隔开,阳极室中的有机物则被微生物氧化降解产生电子和质子,其中的![]() 通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成
通过泵循环至阴极室,经过反硝化反应器中反硝化菌的作用被还原成![]() 。
。
①微生物电化学系统处理有机含氮废水的优点是____。
②写出负极发生反应的电极反应式:_____。
【答案】大于 具有过氧键,有强氧化性 69.6 ![]()
![]()
![]() 、
、![]() 能耗低,以及在产生电能的同时可以进行脱氮消除污染
能耗低,以及在产生电能的同时可以进行脱氮消除污染 ![]()
【解析】
(1)①单位时间内亚硫酸铵的氧化率高,说明反应速率快,分析结构特点不难得出氧化![]() 为
为![]() 的能力是
的能力是![]()
![]() 大于
大于![]() 的原因是其具有过氧键,有强氧化性。②60min内测得方案2体系中亚硫酸铵的氧化量为36mol,计算可得速率为69.6
的原因是其具有过氧键,有强氧化性。②60min内测得方案2体系中亚硫酸铵的氧化量为36mol,计算可得速率为69.6![]() 。
。
(2)反应历程i~iv对应的总反应为添加![]() 将
将![]() 还原成
还原成![]() :
:![]() ,所以第ii步反应为
,所以第ii步反应为![]() 。
。
(3)![]() 与
与![]() 反应的离子方程式为
反应的离子方程式为![]()
![]() ,
,![]() 再生后,实现了利用方案2完整地氧化
再生后,实现了利用方案2完整地氧化![]() 为
为![]() 的过程,总过程可表示为
的过程,总过程可表示为![]() ,所以整个过程中起催化剂作用的是
,所以整个过程中起催化剂作用的是![]() 、
、![]() 。
。
(4)①分析微生物电化学系统,其优点为能耗低,以及在产生电能的同时可以进行脱氮,消除污染。②负极即电池内电路阳极上发生的反应为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】人体的健康有赖于体内各种元素的均衡摄入。
(1)正常人一天的食盐摄入量不超过 6g。
①除去 NaCl溶液中的SO42-,依次加入的溶液为(填溶质的化学式):过量______溶液、过量______溶液、适量稀盐酸。
②食用碘盐是食盐中加入 KIO3。下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。回答下列问题:
配料表 | 精制海盐、碘酸钾(KIO3) |
含碘量 | 20~40 mg/kg |
储藏方法 | 密封避光、防潮 |
食用方法 | 烹调时待食品熟后加入碘盐 |
食用碘盐中“碘”是指______(填“碘离子”或“碘元素”)。推测出碘酸钾(KIO3)化学性质:碘酸钾(KIO3)在高温时______(填“易分解”或“不易分解”)。一种测定含碘量的化学原理是:
(Ι)KIO3 + KI + H2SO4===K2SO4 + I2 + H2O(未配平),
(Ⅱ)I2 + 2Na2S2O3 = 2NaI + Na2S4O8。将反应 Ι 改写为离子方程式_____
(2)成人每天从食物中摄取 0.8 g Ca 元素、0.3 g Mg 元素。
①Ca 元素与 Mg 元素物质的量之比为______。
②墨鱼骨粉(主要成分是 CaCO3),可用作治疗胃酸过多,其原因是_________(用离子方程式回答)。
③从海水中可提取镁:除去混在 Mg(OH)2 中的 Ca(OH)2 的最佳方法是:加入过量的______(填“A”或“B”)(A. MgSO4 溶液 B. MgCl2 溶液),过滤,洗涤,低温烘干。