题目内容
7.工农业废水以及生活污水的大量排放造成水体污染.工业上处理水体中NO3-的一种方法是零价铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下:(1)先用稀硫酸洗去废铁屑表面的铁诱,然后用蒸馏水将铁屑洗净.
①除锈反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O.
②判断铁屑洗净的方法是测最后一次洗涤液的pH,若为7,则说明铁屑已洗净.
(2)将KNO3溶液的pH调至2.5.
①从氧化还原的角度分析调制溶液pH的原因是硝酸在酸性条件下的氧化性强,易被铁屑还原.
②研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是铁粉与H+反应生成H2.
(3)将上述处理过的足量铁屑投入(2)的溶液中.图1表示该反应过程中,体系内相关离子浓度、pH随时间变化关系.t1时刻前该反应的离子方程式是4Fe+NO3-+10H+=4Fe2++NH4++3H2O.
(4)工业上可用纳米铁粉处理地下水中的污染物.一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-.
(5)铁炭混合物(铁屑和活性炭的混合物)也可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图2所示:

①当铁炭混合物中铁的质量分数为0时,也能去除少量的Cu2+和Pb2+,其原因是活性炭对Cu2+和Pb2+具有吸附作用.
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是铁的质量分数的增加,碳铁混合物中国微电池数目减少.
分析 (1)①除锈是用强酸与氧化铁反应;②可以通测最后一次洗涤液的PH的方法成功判断铁屑是否洗净;
(2)①硝酸根离子在酸性条件下才具有强氧化性;
②pH偏低,氢离子浓度偏大,则铁可与氢离子反应生成氢气
(3)根据图示知道t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则是金属铁和硝酸之间的反应;
(4)向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,结合质量守恒、电荷守恒可写出离子方程式;
(5)①当铁炭混合物中铁的质量分数为0时,则只有碳粉,碳粉具有吸附性,可去除水中少量的Cu2+和Pb2+;
②随着铁的质量分数的增加,形成的微电池数目减少,则Cu2+和Pb2+的去除率不升反降.
解答 解:(1)①除锈是用强酸与氧化铁反应,所以离子方程式反应为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
②铁屑洗净的方法是测最后一次洗涤液的PH的方法成功判断铁屑是否洗净,故答案为:测最后一次洗涤液的pH,若为7,则说明铁屑已洗净;
(2)①pH调至2.5,是因为硝酸在酸性条件下的氧化性强,易被铁屑还原,故答案为:硝酸在酸性条件下的氧化性强,易被铁屑还原;
②pH偏低,氢离子浓度偏大,则铁可与氢离子反应生成氢气,可导致NO3-的去除率下降,故答案为:铁粉与H+反应生成H2;
(3)根据图示知道t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则是金属铁和硝酸之间的反应,即4Fe+NO3-+10H+=4Fe2++NH4++3H2O;故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
(4)向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,反应中只有Fe、H元素化合价发生变化,发生氧化还原反应,离子方程式为2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-,
故答案为:2Fe2++BH4-+4OH-=2Fe+2H2↑+B(OH)4-;
(5)①当铁炭混合物中铁的质量分数为0时,则只有碳粉,可去除水中少量的Cu2+和Pb2+,原因是碳粉具有吸附性,也可起到净水的作用,
故答案为:活性炭对Cu2+和Pb2+具有吸附作用;
②随着铁的质量分数的增加,形成的微电池数目减少,反应速率减小,则Cu2+和Pb2+的去除率不升反降,
故答案为:铁的质量分数的增加,碳铁混合物中微电池数目减少.
点评 本题考查了化学方程式的书写、化学反应速率的影响因素、化学实验方案的判断等知识,题目难度较大知识点较多、综合性强,熟练掌握知识的迁移和应用是解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


请回答问題:
(1)按气流方向,各仪器接口从左到右的连接顺序为:
i→c→d→g→h→a→b→j→k→f→e.(填字母编号)
(2)证明Fe2O3己被还原的现象是F中的固体由红棕色变黑色,C中溶液变浑浊.
(3)研究小组对黑色粉末的成分提出下列猜想:
【猜想一】黑色粉末的成分可能是Fe.
【猜想二】黑色粉末的成分可能是FeO.
【猜想三】黑色粉末的成分可能是Fe3O4.
设计并完成实验如表:
| 步骤 | 操作 | 现象 |
| 1 | 加入稀盐酸 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 |
②研究小组又向步骤3的溶液中滴加新制氯水,发现溶液红色褪去.可能的原因及验证方法为假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立.
(4)上述装置还有不妥之处,改进措施为在整套装置的尾气出口处,放置一燃着的酒精灯(或用导管将尾气引至F处酒精灯点燃).
| A. | 碘是人体内必须的微量元素,所以富含高碘酸的食物适合于所有人群 | |
| B. | 化石燃料不完全燃烧会产生CO造成污染,完全燃烧不会造成大气污染 | |
| C. | 利用铁比铜金属性强的性质,常用FeCl3溶液腐蚀Cu来刻制印刷电路板 | |
| D. | 中国古代利用明矾溶液清除铜镜表面的铜镑,是利用了明矾溶液的酸性 |
| A. | 纤维素在人体内可以水解成葡萄糖 | |
| B. | 组成蛋白质的元素中,一定含有碳、氢、氧、氮 | |
| C. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素 | |
| D. | 天然蛋白质水解后的最终产物是a-氨基酸 |
| A. | 氯化钠的电子式  | B. | 乙炔的结构式 H-C=C-H | ||
| C. | 磷原子的结构示意图  | D. | 氨的分子式 NH3 |
 化学反应速率与限度与生产、生活密切相关
化学反应速率与限度与生产、生活密切相关(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率0.1mol/(L•min).(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列AB以减慢反应速率.(填写代号)
A.蒸馏水 B.冰块 C.HNO3溶液 D.CuSO4溶液
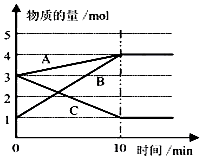
(3)某温度下在10L密闭容器中,3种气态物质A、B、C的物质的量随时间变化曲线如图.
①该反应的化学方程式是2C?A+3B.
②求在该条件达到反应的限度(平衡状态)时反应物的转化率【转化率=$\frac{转化的物质的量}{初始物质的量}$×100%】,请写出计算过程,计算结果保留1位小数)
| A. | 勒夏特列 | B. | 汤姆生 | C. | 阿伏伽德罗 | D. | 门捷列夫 |
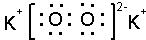 ;
;