题目内容
碘酸钾作为食盐-碘添加剂,而碘化钾则是化工生产中一种重要原料.还原法生产碘化钾是由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原而得,其主要流程如图
请回答下列问题:

(1)判断“合成”过程中,碘是否已完全反应的方法是 .
(2)实验室中,过滤操作要求“一贴二低三靠”,其中“三靠”是指盛有被过滤液体的烧杯注液口紧靠玻璃棒、 、 .
操作a 包括“蒸发浓缩、冷却结晶”是依据KI具有何种性质: .
(3)写出“合成”过程中,HCOOH参与的离子反应方程式: .
(4)测定产品中KI含量的方法是:
a.称取3.340g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL溶液于锥形瓶中,加入足量KIO3,用少量稀硫酸酸化所,使KIO3与KI反应完全;
c.以淀粉为指示剂,用0.2400mol/L的Na2S2O3溶液滴定,消耗溶液体积平均值为10.00mL.
已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-.
①测定过程所需仪器在使用前必须检查是否漏液的有 .
②该样品中KI的质量分数为 .(保留3位有效数字)
(5)有学生选用家庭厨房中的有关调料(如黄酒、白醋、酱油、味精等),用简便方法来检测是否是加碘食盐.通过实践,发现厂商只要在食盐包装的封口处夹一条碘化钾淀粉试纸,并在袋上注明使用方法就能鉴别真伪.现请你写出检测使用说明书.
请回答下列问题:

(1)判断“合成”过程中,碘是否已完全反应的方法是
(2)实验室中,过滤操作要求“一贴二低三靠”,其中“三靠”是指盛有被过滤液体的烧杯注液口紧靠玻璃棒、
操作a 包括“蒸发浓缩、冷却结晶”是依据KI具有何种性质:
(3)写出“合成”过程中,HCOOH参与的离子反应方程式:
(4)测定产品中KI含量的方法是:
a.称取3.340g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL溶液于锥形瓶中,加入足量KIO3,用少量稀硫酸酸化所,使KIO3与KI反应完全;
c.以淀粉为指示剂,用0.2400mol/L的Na2S2O3溶液滴定,消耗溶液体积平均值为10.00mL.
已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-.
①测定过程所需仪器在使用前必须检查是否漏液的有
②该样品中KI的质量分数为
(5)有学生选用家庭厨房中的有关调料(如黄酒、白醋、酱油、味精等),用简便方法来检测是否是加碘食盐.通过实践,发现厂商只要在食盐包装的封口处夹一条碘化钾淀粉试纸,并在袋上注明使用方法就能鉴别真伪.现请你写出检测使用说明书.
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题,实验设计题
分析:由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原碘酸钾生成KI和二氧化碳气体,调节溶液pH过滤除去杂质,溶液经蒸发浓缩、冷却结晶、分离、干燥可得到碘化钾,
(1)可用淀粉检验碘是否完全反应;
(2)过滤时,盛有被过滤液体的烧杯注液口紧靠玻璃棒、玻璃棒下端紧靠三层滤纸处、漏斗下端尖口紧靠烧杯内壁;操作a 包括“蒸发浓缩、冷却结晶”,说明KI的
溶解度随温度的影响较大;
(3)由题意可知甲酸还原碘酸钾生成KI和二氧化碳气体,同时生成水;
(4)测定产品中KI含量使用容量瓶和滴定管,使用前必须检查是否漏水;结合关系式法计算;
(5)可用试纸与食盐在酸性条件下发生反应制备碘,厨房中可用醋酸酸化.
(1)可用淀粉检验碘是否完全反应;
(2)过滤时,盛有被过滤液体的烧杯注液口紧靠玻璃棒、玻璃棒下端紧靠三层滤纸处、漏斗下端尖口紧靠烧杯内壁;操作a 包括“蒸发浓缩、冷却结晶”,说明KI的
溶解度随温度的影响较大;
(3)由题意可知甲酸还原碘酸钾生成KI和二氧化碳气体,同时生成水;
(4)测定产品中KI含量使用容量瓶和滴定管,使用前必须检查是否漏水;结合关系式法计算;
(5)可用试纸与食盐在酸性条件下发生反应制备碘,厨房中可用醋酸酸化.
解答:
解:由碘与氢氧化钾反应生成碘酸钾后,用甲酸还原碘酸钾生成KI和二氧化碳气体,调节溶液pH过滤除去杂质,溶液经蒸发浓缩、冷却结晶、分离、干燥可得到碘化钾,
(1)可用淀粉检验碘是否完全反应,操作方法为取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应,
故答案为:取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应,反之则未完全反应;
(2)过滤时,盛有被过滤液体的烧杯注液口紧靠玻璃棒、玻璃棒下端紧靠三层滤纸处、漏斗下端尖口紧靠烧杯内壁;操作a 包括“蒸发浓缩、冷却结晶”,说明KI的
溶解度随温度的影响较大,
故答案为:玻璃棒下端紧靠三层滤纸处;漏斗下端尖口紧靠烧杯内壁;碘化钾在水中的溶解度随温度的影响较大;
(3)甲酸还原碘酸钾生成KI和二氧化碳气体,同时生成水,反应的离子方程式为3HCOOH+IO3-=I-+3H2O+3CO2↑,
故答案为:3HCOOH+IO3-=I-+3H2O+3CO2↑;
(4)①测定产品中KI含量使用容量瓶和滴定管,使用前必须检查是否漏水,故答案为:250mL容量瓶、滴定管;
②KIO3与KI反应完全的化学方程式为IO3-+5I-+6H+=3I2+3H2O,
反应的关系式为5I-~3I2~6S2O32-,n(Na2S2O3)=0.2400mol/L×0.01L=2.4×10-3mol,
由关系式可知n(KI)=2.4×10-3mol×
=2×10-3mol,
则3.340g样品中含有KI的质量为2×10-3mol×
×166g/mol=3.32g,
则样品中KI的质量分数为
×100%=0.994或99.4%,
故答案为:0.994或99.4%;
(5)可用试纸与食盐在酸性条件下发生反应制备碘,厨房中可用醋酸酸化,方法为取少量食盐样品放入小碗(或玻璃杯)中,加少量白醋,用筷子搅拌片刻,然后蘸取液体点在试纸上,如果试纸变蓝即为加碘盐,否则不是碘盐,
答:取少量食盐样品放入小碗(或玻璃杯)中,加少量白醋,用筷子搅拌片刻,然后蘸取液体点在试纸上,如果试纸变蓝即为加碘盐,否则不是碘盐.
(1)可用淀粉检验碘是否完全反应,操作方法为取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应,
故答案为:取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应,反之则未完全反应;
(2)过滤时,盛有被过滤液体的烧杯注液口紧靠玻璃棒、玻璃棒下端紧靠三层滤纸处、漏斗下端尖口紧靠烧杯内壁;操作a 包括“蒸发浓缩、冷却结晶”,说明KI的
溶解度随温度的影响较大,
故答案为:玻璃棒下端紧靠三层滤纸处;漏斗下端尖口紧靠烧杯内壁;碘化钾在水中的溶解度随温度的影响较大;
(3)甲酸还原碘酸钾生成KI和二氧化碳气体,同时生成水,反应的离子方程式为3HCOOH+IO3-=I-+3H2O+3CO2↑,
故答案为:3HCOOH+IO3-=I-+3H2O+3CO2↑;
(4)①测定产品中KI含量使用容量瓶和滴定管,使用前必须检查是否漏水,故答案为:250mL容量瓶、滴定管;
②KIO3与KI反应完全的化学方程式为IO3-+5I-+6H+=3I2+3H2O,
反应的关系式为5I-~3I2~6S2O32-,n(Na2S2O3)=0.2400mol/L×0.01L=2.4×10-3mol,
由关系式可知n(KI)=2.4×10-3mol×
| 5 |
| 6 |
则3.340g样品中含有KI的质量为2×10-3mol×
| 250 |
| 25 |
则样品中KI的质量分数为
| 3.32 |
| 3.34 |
故答案为:0.994或99.4%;
(5)可用试纸与食盐在酸性条件下发生反应制备碘,厨房中可用醋酸酸化,方法为取少量食盐样品放入小碗(或玻璃杯)中,加少量白醋,用筷子搅拌片刻,然后蘸取液体点在试纸上,如果试纸变蓝即为加碘盐,否则不是碘盐,
答:取少量食盐样品放入小碗(或玻璃杯)中,加少量白醋,用筷子搅拌片刻,然后蘸取液体点在试纸上,如果试纸变蓝即为加碘盐,否则不是碘盐.
点评:本题考查较为综合,涉及物质的分离、提纯以及含量的测定等知识,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,题目难度中等,本题注意从质量守恒的角度利用关系式法计算纯度.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1mol Cu和足量稀硝酸反应产生NA个NO分子 | ||
B、在18g
| ||
| C、1 molCl2参加反应转移电子数一定为2NA | ||
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为mol.L-1 |
下列实验能达到目的是( )
| A、用AgNO3溶液可鉴别HCl溶液和NaCl溶液 | ||||
B、用BaCl2溶液鉴别SO
| ||||
| C、用浓HNO3与Cu反应制备NO2 | ||||
| D、将混合HCl的Cl2通入饱和NaHCO3溶液中 |



 为测定某种碱金属的相对原子质量,设计了如图所示的装置,该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中.立即塞紧瓶塞,完全反应后,此装置的总质量为cg.则:
为测定某种碱金属的相对原子质量,设计了如图所示的装置,该装置(包括水)的总质量为ag,将质量为bg(不足量)的碱金属放入水中.立即塞紧瓶塞,完全反应后,此装置的总质量为cg.则:
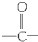 )的化合物
)的化合物 (R,R′代表烷基或H原子)发生缩合反应生成新的有机物和水,苯酚还可跟酰氯
(R,R′代表烷基或H原子)发生缩合反应生成新的有机物和水,苯酚还可跟酰氯 反应生成有机酸酯,例如
反应生成有机酸酯,例如
