题目内容
8.硅单质及其化合物应用很广.请回答下列问题:(1)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
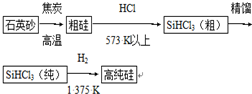
①写出由纯SiHCl3制备高纯硅的化学反应方程式SiHCl3+H2$\frac{\underline{\;1375K\;}}{\;}$Si+3HCl.
②整个制备过程必须严格控制无水、无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl↑;
(2)下列有关硅材料的说法正确的是AD.
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入盐酸,振荡.写出实验现象并给予解释(用化学方程式说明)生成白色絮状沉淀,Na2SiO3+2HCl=2NaCl+H2SiO3↓.
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是B(填字母).
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷.
分析 (1)①纯SiHCl3与氢气反应生成硅和氯化氢;
②依据原子个数守恒结合化合价变化写出方程式;
(2)A.硅与氢氧化钠反应生成硅酸钠和氢气;
B.硅与盐酸不反应;
C.玻璃为混合物,不存在固定的熔点;
D.二氧化硅为光导纤维的主要成分;
(3)盐酸的酸性强于硅酸,盐酸与硅酸钠反应生成硅酸沉淀和氯化钠;
(4)用于人体器官的陶瓷,应具有良好的生物性能,据此分析.
解答 解:(1)①纯SiHCl3与氢气反应生成硅和氯化氢,方程式为:SiHCl3+H2 $\frac{\underline{\;1375K\;}}{\;}$Si+3HCl;
②SiHCl3遇水剧烈反应生成H2SiO3、HCl和氢气,化学方程式为:SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl↑;
故答案为:SiHCl3+3H2O=H2SiO3↓+H2↑+3HCl↑;
(2)A.硅与氢氧化钠反应生成硅酸钠和氢气,可以被强碱溶液腐蚀,故A正确;
B.硅与盐酸不反应,故B错误;
C.玻璃为混合物,不存在固定的熔点,故C错误;
D.二氧化硅为光导纤维的主要成分,故D正确;
故选:AD;
(3)盐酸的酸性强于硅酸,盐酸与硅酸钠反应生成硅酸沉淀和氯化钠,离子方程式:生成白色絮状沉淀,Na2SiO3+2HCl=2NaCl+H2SiO3↓;
故答案为:生成白色絮状沉淀,Na2SiO3+2HCl=2NaCl+H2SiO3↓;
(4)用于人体器官的陶瓷,应具有良好的生物性能,
故选B.
点评 本题考查了硅及其化合物的性质和用途,熟悉物质的化学性质是解题关键,注意相关知识的积累.

练习册系列答案
相关题目
9.某溶液含有HCO3-、Cl-、SO32-、SO42-,向其中加入Na2O2固体(溶液体积变化可忽略),不能引起下列离子浓度发生明显变化的是( )
| A. | HCO3- | B. | Cl- | C. | SO32- | D. | SO42- |
10.向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( )
| A. | 白色沉淀为ZnS,而黑色沉淀为CuS | |
| B. | 利用该原理可实现一种沉淀转化为更难溶的沉淀 | |
| C. | 该过程破坏了ZnS的溶解平衡 | |
| D. | 上述现象说明ZnS的Ksp小于CuS的Ksp |
3.下列有关化学实验的叙述正确的是( )
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 配制FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 | |
| C. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| D. | Na2CO3溶液保存在带玻璃塞的试剂瓶中 |
13.现有FeCl3、CuCl2、MgSO4、K2CO3四种盐的溶液,只用一种试剂便可鉴别,这种试剂可能是下列的( )
| A. | Ba(OH)2溶液 | B. | NaOH溶液 | C. | KNO3溶液 | D. | AgNO3溶液 |
20.设NA为阿伏伽德罗常数的值.下列说法正确的是(相对原子量:N-14 H-1)( )
| A. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| B. | 标准状况下,2.24L H2O中含有H2O分子数为0.1NA | |
| C. | 1L 0.1mol/L NaHSO4溶液中含有的阳离子数目为0.1NA | |
| D. | 实验室所制得的1.7g NH3中含有的电子数为NA |
17.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是( )
| A. | CO2 | B. | PCl3 | C. | CCl4 | D. | H2O |
18.将40mL 0.2mol/L NaOH溶液和20mL0.2mol/L的CH3COOH溶液混和,充分反应后蒸干并加强热,最终得到的固体是( )
| A. | Na2CO3 | B. | CH3COONa | ||
| C. | NaOH和CH3COONa的混合物 | D. | NaOH |
 ;CaCl2
;CaCl2 .
.