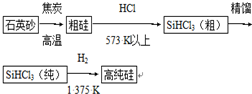
题目内容
18.将40mL 0.2mol/L NaOH溶液和20mL0.2mol/L的CH3COOH溶液混和,充分反应后蒸干并加强热,最终得到的固体是( )| A. | Na2CO3 | B. | CH3COONa | ||
| C. | NaOH和CH3COONa的混合物 | D. | NaOH |
分析 n(NaOH)=0.008mol,n(CH3COOH)=0.004mol,反应后溶质为NaOH和CH3COONa,蒸干并强热,可最终生成碳酸钠.
解答 解:反应后溶质为NaOH和CH3COONa,蒸干并强热,醋酸钠分解,且与空气中氧气、二氧化碳反应,最终产物为Na2CO3,
故选A.
点评 本题考查钠的重要化合物,为高频考点,侧重于学生的分析能力的考查,注意把握醋酸钠、氢氧化钠在空气中的变化,难度不大.

练习册系列答案
相关题目
9.下列说法中,正确的是( )
| A. | 1-丁烯和2-丁烯都存在顺反异构现象 | |
| B. | 一氯甲烷不存在同分异构体的事实可以证明甲烷分子是正四面体形分子 | |
| C. | 间二氯苯只有一种结构的事实可以证明苯分子是正六边形分子 | |
| D. | 苯不能使高锰酸钾酸性溶液或溴的四氯化碳溶液褪色可以证明苯分子中的碳碳键完全相同 |
6.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2L0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1molNa2O2固体中含离子总数为4NA | |
| D. | 丙烯(CH2=CH-CH3)和环丙烷组成的42g混合气体中氢原子的个数为6NA |
3.下列实验不能达到目的是( )
| A. | 将饱和氯水滴到蓝色石蕊试纸上,试纸先变红后褪色,证明氯水具有漂白性 | |
| B. | 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强 | |
| C. | 将铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝的熔点高于铝 | |
| D. | 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了反应而成碱性 |
10.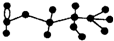 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
 某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有
某有机物含有C、H、O三种元素,其球棍模型如图所示.该有机物可能发生的反应有①水解 ②加聚 ③取代 ④消去 ⑤银镜( )
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ①③④ | D. | ①④⑤ |
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| B. | 常温常压下,22 g CO2中所含的共用电子对数为2NA | |
| C. | 25℃时,pH=2的醋酸冲稀10倍后,溶液中H+数目大于0.001 NA | |
| D. | 密闭容器中加入一定量的H2和N2,反应生成1mol NH3时转移电子数小于3NA |