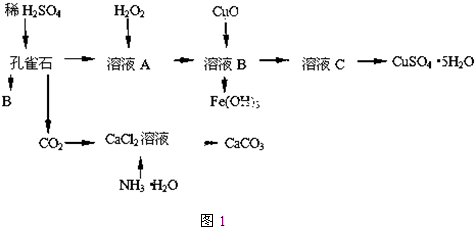
题目内容
在溶液中0.2mol X2O72-恰好能使0.6mol SO32-被完全氧化,则X2O72-被还原后X元素的化合价为( )
| A、+1 | B、+2 | C、+3 | D、+4 |
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:0.2molX2O72-能使0.6molSO32-完全氧化成SO42-,则S元素的化合价由+4价升高为+6价,所以X元素的化合价降低,设X2O72-被还原后X的化合价为x,利用电子守恒来计算x即可.
解答:
解:0.2molX2O72-能使0.6molSO32-完全氧化成SO42-,S元素的化合价由+4价升高为+6价,则X元素的化合价降低,
设X2O72-被还原后X的化合价为x,
由电子守恒可得:0.2mol×2×(6-x)=0.6mol×(6-4),
解得x=+3,
故选C.
设X2O72-被还原后X的化合价为x,
由电子守恒可得:0.2mol×2×(6-x)=0.6mol×(6-4),
解得x=+3,
故选C.
点评:本题考查氧化还原反应的计算,题目难度中等,明确氧化还原反应中电子守恒是解答本题的关键,注意氧化剂中X的原子个数为解答的易错点,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
某溶液中可能含有K+、NH4+、Ba2+、SO42-、I-.分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A、Ba2+ |
| B、NH4+ |
| C、K+ |
| D、SO42- |
下列叙述正确的是( )
| A、结合质子(H+)能力:OH->CH3COO->Cl- |
| B、除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 |
| C、F、Cl、Br的最外层电子数都是7,次外层电子数都是8 |
| D、X、Y均为短周期元素,其简单离子mXa+与nYb-的电子层结构相同,则m+a=n-b |
下列说法中错误的是( )
| A、CO2、SO3都是极性分子 |
| B、KF是离子化合物,HF为共价化合物 |
| C、在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| D、PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
 氯化钠是我们日常生活的必需品,也是重要的化工原料,可以制备一系列物质.氯化钠的用途如图所示,下列说法错误的是( )
氯化钠是我们日常生活的必需品,也是重要的化工原料,可以制备一系列物质.氯化钠的用途如图所示,下列说法错误的是( )A、NaHCO3受热分解的方程式为:2NaHCO3
| ||||
| B、Cl2与Ca(OH)2的反应中,Cl2作氧化剂,Ca(OH)2作还原剂 | ||||
| C、Cl2与过量的Fe反应的产物为FeCl3 | ||||
D、电解熔融态氯化钠的方程式为:2NaCl
|
矿泉水是人们居家旅游常用的饮料,市场上有些不法商贩为牟取暴利,用自来水(用氯气消毒)冒充矿泉水出售.为辨别真伪,可用下列的一种化学试剂来鉴别,该试剂是( )
| A、酚酞试液 |
| B、氯化钡溶液 |
| C、氢氧化钠溶液 |
| D、硝酸银溶液 |