题目内容
17gNH3共有 mol原子,0.1molH2S共有 个氢原子;同质量的NH3和H2S中分子个数比为 .在标准状况下,71g氯气(Cl2)的体积是 L,将其与氢气完全化合生成HCl,需氢气的物质的量是 mol,将生成的气体配制成1L溶液,溶质的物质的量浓度是 mol?L-1,将此溶液取出20mL加蒸馏水制成200mL溶液,此冲稀后溶液中溶质的物质的量浓度是 mol?L-1.
考点:物质的量的相关计算
专题:计算题
分析:根据n=
计算17g 氨气的物质的量,含有原子物质的量为氨气的4倍;
硫化氢分子中氢原子物质的量为硫化氢的2倍,再根据N=nNA计算氢原子数目;
根据n=
可知,同质量的NH3和H2S中分子数目之比与摩尔质量成反比;
根据n=
计算71g 氯气的物质的量,再根据V=nVm计算氯气的体积,根据H2+Cl2=2HCl计算氢气的物质的量、生成HCl的物质的量,根据c=
计算盐酸的物质的量浓度,溶液是均匀的,取出20mL溶液的浓度与原溶液浓度相等,根据稀释定律计算稀释后溶液浓度.
| m |
| M |
硫化氢分子中氢原子物质的量为硫化氢的2倍,再根据N=nNA计算氢原子数目;
根据n=
| m |
| M |
根据n=
| m |
| M |
| n |
| V |
解答:
解:17g 氨气的物质的量=
=2mol,含有原子物质的量为2mol×4=8mol;
0.1mol硫化氢分子中氢原子物质的量为0.1mol×2=0.2mol,含有氢原子数目为0.2 NA;
根据n=
可知,同质量的NH3和H2S中分子数目之比=34g/mol:17g/mol=2:1;
71g 氯气的物质的量=
=1mol,标况下氯气的体积=1mol×22.4L/mol=22.4L,根据H2+Cl2=2HCl,可知氢气的物质的量为1mol,生成HCl的物质的量=1mol×2=2mol,所得盐酸的物质的量浓度
=2mol/L,溶液是均匀的,取出20mL溶液的浓度与原溶液浓度相等,根据稀释定律,稀释后溶液浓度=
=0.2mol/L,
故答案为:4;0.2 NA;2:1;22.4;1;2;0.2.
| 17g |
| 34g/mol |
0.1mol硫化氢分子中氢原子物质的量为0.1mol×2=0.2mol,含有氢原子数目为0.2 NA;
根据n=
| m |
| M |
71g 氯气的物质的量=
| 71g |
| 71g/mol |
| 2mol |
| 1L |
| 20mL×2mol/L |
| 200mL |
故答案为:4;0.2 NA;2:1;22.4;1;2;0.2.
点评:本题考查物质的量有关计算,比较基础,侧重对基础知识的巩固,注意掌握以物质的量为中心的有关计算.

练习册系列答案
相关题目
下列分子中,所有原子都在同一条直线上的是( )
| A、C2H2 |
| B、C2H4 |
| C、C2H6 |
| D、CO2 |
下列装置或操作合理的是( )
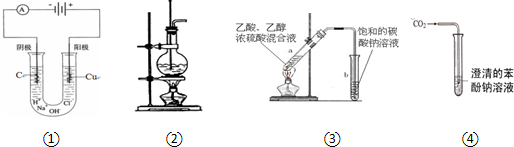

| A、装置①可用于实验室制取少量氯气 |
| B、装置②可用于实验室制取少量乙烯 |
| C、装置③可用于制备少量的乙酸乙酯 |
| D、装置④可用于比较碳酸与苯酚的酸性强弱 |
下列各组离子在指定条件下,一定能大量共存的是( )
| A、能使红色石蕊试纸显蓝色的溶液:K+、Na+、SO42-、C2O42- |
| B、能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- |
| C、水电离出的c(H+)=10-12 mol/L的溶液:Ba2+、Na+、SO3-、S2- |
| D、加入铝条有氢气放出的溶液:Na+、NH4+、Cl-、NO3- |
