题目内容
5.表为元素周期表的一部分(数字为原子序数),其中X为35的是( )| A. |
| B. |
| C. |
| D. |
|
分析 根据原子序数,结合元素周期表结构确定元素在周期表中位置,再结合各元素位置关系进行判断.
解答 解:X的原子序数为35,为Br元素,位于周期表中第四周期第ⅤⅡA族.
A.14号,50号元素分别为Si、Sn,处于第ⅣA族,则X的原子序数为33,不符合,故A错误;
B、25号,28号元素分别为Fe、Ni,图中X处于第五周期第Ⅷ族,故B错误;
C、74号处于第六周期ⅥB族,76号元素处于第六第Ⅷ族,图中X的原子序数为43,处于第五周期第ⅦB族,故C错误;
D、18号、54号元素分别为Ar、Xe,则X位于周期表中第四周期第ⅤⅡA族,符合题意,故D正确;
故选D.
点评 本题考查元素周期表的结构,难度不大,注意根据原子序数判断物质在周期表位置.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
15.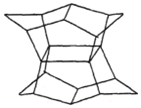 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
 1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )
1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图的多环有机分子,因其形状像东方塔式庙宇,所以该分子也就称为pagodane(庙宇烷),有关该分子的说法不正确的是( )| A. | 分子式为C20H20 | B. | 一氯代物的同分异构体只有两种 | ||
| C. | 分子中含有4个亚甲基(-CH2-) | D. | 分子中含有12个五元碳环 |
16.已知:
C(s)+H2O(g)═CO(g)+H2(g)△H=a kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
H-H、O═O和O-H键的键能分别为436kJ•mol-1、496kJ•mol-1和462kJ•mol-1,则a为( )
C(s)+H2O(g)═CO(g)+H2(g)△H=a kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-220kJ•mol-1
H-H、O═O和O-H键的键能分别为436kJ•mol-1、496kJ•mol-1和462kJ•mol-1,则a为( )
| A. | -332 | B. | +260 | C. | +350 | D. | +130 |
20. 据报道,以硼氢化合物 NaBH4(B 元素的化合价为+3 价)和 H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用 MnO2,可用作空军通信卫星电源,其工作原理如图所 示.下列说法正确的是( )
据报道,以硼氢化合物 NaBH4(B 元素的化合价为+3 价)和 H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用 MnO2,可用作空军通信卫星电源,其工作原理如图所 示.下列说法正确的是( )
 据报道,以硼氢化合物 NaBH4(B 元素的化合价为+3 价)和 H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用 MnO2,可用作空军通信卫星电源,其工作原理如图所 示.下列说法正确的是( )
据报道,以硼氢化合物 NaBH4(B 元素的化合价为+3 价)和 H2O2作原料的燃料电池,负极材料采用 Pt/C,正极材料采用 MnO2,可用作空军通信卫星电源,其工作原理如图所 示.下列说法正确的是( )| A. | 电池放电时 Na+从 b 极区移向 a 极区 | |
| B. | 每消耗 3mol H2O2,转移的电子为3mol | |
| C. | 电极 a 采用 MnO2,MnO2 既作电极材料又有催化作用 | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
10.下列物质与水混合后,显著放热的是( )
| A. | 生石灰 | B. | 无水乙醇 | C. | 浓硫酸 | D. | 固体硝酸铵 |
17. 科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
 科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )
科学家合成了具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | Al2H6中铝的杂化方式为sp3杂化 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | Al2H6中含有离子键和极性共价键 | |
| D. | Al2H6在空气中完全燃烧,产物为三氧化二铝和水 |
1.下列有关说法正确的是( )
| A. | 12753I和13153I是质子数相同的同种核素 | |
| B. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3 | |
| C. | 实验室制取氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| D. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 |

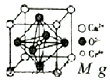 铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是:
铬及其化合物广泛应用于生活、生产.酒精测量仪的原理是: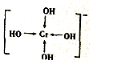 .
.