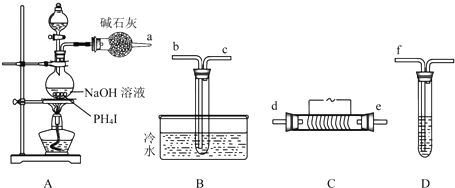
题目内容
4.据史书记载,我国古代的炼丹师在长期的炼制丹药过程中,发现硝、硫磺和木炭的混合物能够燃烧爆炸,由此诞生了中国古代四大发明之一的火药.其中配方中的“硝”是指( )| A. | KNO3 | B. | K2CO3 | C. | HNO3 | D. | Na2SO4 |
分析 黑火药是我国古代的四大发明之一,它是硝酸钾、硫粉、木炭粉按一定比例混合而成的.
解答 解:黑火药是我国古代的四大发明之一,它是硝酸钾、硫粉、木炭粉按一定比例混合而成的,硝是指硝酸钾.
故选A.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
12.下列实验操作能达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 将潮湿的NH3通过盛有无水CaCl2的干燥管 | 除去NH3中的水蒸气 |
| B | 往铁和稀硝酸反应后的溶液中滴入KSCN溶液 | 验证溶液中是否含有Fe3+ |
| C | 甲基橙作指示剂,用标准NaOH溶液滴定盐酸至红色 | 测量盐酸物质的量浓度 |
| D | 向2ml0.2mol/L的AgNO3溶液中先后滴加0.2mol/L 的NaCl溶液、KBr溶液各5滴 | 确定AgCl、AgBr的Kap的相对大小 |
| A. | A | B. | B | C. | C | D. | D |
19.1L某溶液中含有的离子如下表:
用惰性电极电解该溶液,当电路中有3mole-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是( )
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 阳极生成1.5mol Cl2 | B. | a=3 | ||
| C. | 电解后溶液中c(H+)=1moL/L | D. | 阴极析出的金属是铜与铝 |
16.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 2.0 g D218O中含有的质子数为NA | |
| B. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4 NA | |
| C. | 78 g Na2O2晶体中所含阴、阳离子个数均为2 NA | |
| D. | 1 mol Fe完全溶于一定量的硝酸溶液中,转移的电子数一定是3 NA |
13.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第三周期VA族.
(2)Z、W形成的气态氢物的稳定性由强到弱顺序为H2S>PH3.(填化学式)
(3)XW2的化学式为CS2.
(4)Y的最高价氧化物的化学式为HNO3.
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第三周期VA族.
(2)Z、W形成的气态氢物的稳定性由强到弱顺序为H2S>PH3.(填化学式)
(3)XW2的化学式为CS2.
(4)Y的最高价氧化物的化学式为HNO3.
14.可用于分离MgCl2与AlCl3混合溶液的是( )
| A. | 氢氧化钠、盐酸 | B. | 盐酸、氨水 | ||
| C. | 氢氧化钠、氨水 | D. | 氢氧化钠、二氧化碳 |
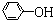 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子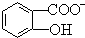 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是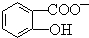 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.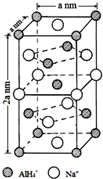 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. (标明配位键).
(标明配位键).