题目内容
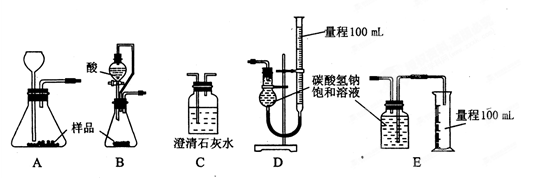
(12分)已知某纯碱样品中含有 NaCl杂质,为测
NaCl杂质,为测 定样品中纯碱的质量分数,甲同学用下图装置及试剂进行实验(夹持仪器略)。填写下列空白处。
定样品中纯碱的质量分数,甲同学用下图装置及试剂进行实验(夹持仪器略)。填写下列空白处。
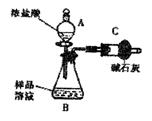
(1)仪器A、B的名称分别是 、 。
(2)甲同学按实验正常操作的主要步骤如下:
① ;
②将ag试样放入仪器B中,加适量蒸馏水溶解,得到样品溶液;
③称量盛有碱石灰的干燥管的质量为bg;
④从仪器A中滴入浓盐酸,直到不再产生气体时为止;
⑤再次称量盛有碱石灰的干燥管的质量为cg;
(3)甲同学根据以上实验求得的样品中Na2CO3的质量分数是 (用含a、b、c的式子表示)
(4)乙同学认为甲同学在实验装置设计和使用药品上都有缺陷,会导致测得的Na2CO3的质量分数偏高,而丙同学则认为甲同学的实验装置会使测得的结果偏低,丙同学认为结果偏低的原因可能是:
。
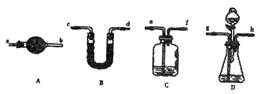
(5)若要解决乙、丙同学指出的甲同学实验中的问题,可对甲同学的实验装置和实验药品进行适当的改动,请按合理顺序选择仪器并完成下表:(用大写字母代表仪器,仪器 可重复使用,夹持仪器略)
可重复使用,夹持仪器略)
 NaCl杂质,为测
NaCl杂质,为测 定样品中纯碱的质量分数,甲同学用下图装置及试剂进行实验(夹持仪器略)。填写下列空白处。
定样品中纯碱的质量分数,甲同学用下图装置及试剂进行实验(夹持仪器略)。填写下列空白处。
(1)仪器A、B的名称分别是 、 。
(2)甲同学按实验正常操作的主要步骤如下:
① ;
②将ag试样放入仪器B中,加适量蒸馏水溶解,得到样品溶液;
③称量盛有碱石灰的干燥管的质量为bg;
④从仪器A中滴入浓盐酸,直到不再产生气体时为止;
⑤再次称量盛有碱石灰的干燥管的质量为cg;
(3)甲同学根据以上实验求得的样品中Na2CO3的质量分数是 (用含a、b、c的式子表示)
(4)乙同学认为甲同学在实验装置设计和使用药品上都有缺陷,会导致测得的Na2CO3的质量分数偏高,而丙同学则认为甲同学的实验装置会使测得的结果偏低,丙同学认为结果偏低的原因可能是:
。
(5)若要解决乙、丙同学指出的甲同学实验中的问题,可对甲同学的实验装置和实验药品进行适当的改动,请按合理顺序选择仪器并完成下表:(用大写字母代表仪器,仪器
 可重复使用,夹持仪器略)
可重复使用,夹持仪器略)
选用的 仪器 仪器 | | | | | |
| 添加的药品及必要的操作 | | | | | |
(12分)(1)分液漏斗、锥形瓶(2分)
(2)①按图组装仪器,并检查装置的气密性(2分)
(3)53(c-b)/22a ×100%(2分)(4)装置中残留有CO2,未被碱石灰吸收(2分)
(5)(4分;仪器答对2个给1分,全对2分;对应药品答对2个给1分,全对给2分。)
(2)①按图组装仪器,并检查装置的气密性(2分)
(3)53(c-b)/22a ×100%(2分)(4)装置中残留有CO2,未被碱石灰吸收(2分)
(5)(4分;仪器答对2个给1分,全对2分;对应药品答对2个给1分,全对给2分。)
| 选项用的仪器 | C | D | C | A | B |
| 添加的药品及必要的操作 | NaOH溶液从e口鼓入空气 | 稀硫酸 样品溶液 | 浓硫酸 | 碱石灰 | 碱石灰 |
略

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目


 5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。
5.00mL加入过量的c1mol·L-lV1mL碘溶液,充分反应后再用c2mol·L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液。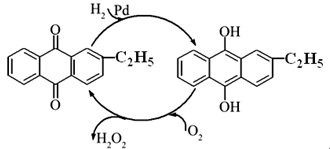
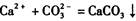 的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。
的反应设计了如下方案:称取样品→配成溶液→加入足量浓CaCl2溶液→充分反应后过滤→洗涤→干燥→称量→计算纯度。