题目内容
在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子.进行下述实验(所加试剂均过量).

(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 ;
(3)写出溶液C与过量氨水反应的离子方程式 .

(1)气体A的化学式是
(2)待测液中一定存在
(3)写出溶液C与过量氨水反应的离子方程式
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:澄清、透明的浅黄色溶液,说明溶液含有Fe3+,Fe3+与HCO3-发生水解反应,故HCO3-不存在;待测溶液加入过量NaOH溶液,生成沉淀A与气体A,根据提供的离子可知,只有Fe3+与NaOH反应生成沉淀,只有NH4+与NaOH反应生成气体,沉淀A为Fe(OH)3,气体A为NH3,故原溶液中含有NH4+;溶液A中加入过量的BaC12溶液、稀盐酸,生成沉淀B,溶液中只有SO42-与BaC12溶液反应生成沉淀,故沉淀B为硫酸钡,说明原溶液中含有SO42-,则溶液中一定不含Ba2+;溶液B加入过量的硝酸银溶液、稀硝酸,生成白色沉淀C,故白色沉淀C为AgCl,由于前边操作引入Cl-,不能证明原溶液含有Cl-;溶液C中加入过量的氨水,生成沉淀,银离子转化为银氨络离子,故沉淀为Al(OH)3 ,说明原溶液中一定含有Al3+;溶液D中含有硝酸根、银氨络离子、氨水等;K+、Cl-无法确定,据此解答.
解答:
解:澄清、透明的浅黄色溶液,说明溶液含有Fe3+,Fe3+与HCO3-发生水解反应,故HCO3-不存在.待测溶液加入过量NaOH溶液,生成沉淀A与气体A,根据提供的离子可知,只有Fe3+与NaOH反应生成沉淀,只有NH4+与NaOH反应生成气体,沉淀A为Fe(OH)3,气体A为NH3,故原溶液中含有NH4+.溶液A中加入过量的BaC12溶液、稀盐酸,生成沉淀B,溶液中只有SO42-与BaC12溶液反应生成沉淀,故沉淀B为硫酸钡,说明原溶液中含有SO42-,则溶液中一定不含Ba2+.溶液B加入过量的硝酸银溶液、稀硝酸,生成白色沉淀C,故白色沉淀C为AgCl,由于前边操作引入Cl-,不能证明原溶液含有Cl-.溶液C中加入过量的氨水,生成沉淀,银离子转化为银氨络离子,故沉淀为Al(OH)3 ,说明原溶液中一定含有Al3+.溶液D中含有硝酸根、银氨络离子、氨水等.K+、Cl-无法确定.
(1)由上述分析可知,气体A是NH3,沉淀A是Fe(OH)3,
故答案为:NH3;Fe(OH)3;
(2)由上述分析可知,待测液中一定存在NH4+、Al3+、Fe3+、SO42-;一定不存在 Ba2+、HCO3-;
故答案为:NH4+、Al3+、Fe3+、SO42-;Ba2+、HCO3-;
(3)溶液C与过量氨水反应主要是Al3+与NH3?H2O反应,生成Al (OH)3与 NH4+,反应的离子方程式为Al3++3NH3?H2O=Al (OH)3↓+3 NH4+.
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3 NH4+.
(1)由上述分析可知,气体A是NH3,沉淀A是Fe(OH)3,
故答案为:NH3;Fe(OH)3;
(2)由上述分析可知,待测液中一定存在NH4+、Al3+、Fe3+、SO42-;一定不存在 Ba2+、HCO3-;
故答案为:NH4+、Al3+、Fe3+、SO42-;Ba2+、HCO3-;
(3)溶液C与过量氨水反应主要是Al3+与NH3?H2O反应,生成Al (OH)3与 NH4+,反应的离子方程式为Al3++3NH3?H2O=Al (OH)3↓+3 NH4+.
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3 NH4+.
点评:本题考查离子的推断与检验、离子反应、元素化合物的性质等,难度较大,明确物质的性质及离子之间的反应是解题关键,注意元素化合物知识的掌握.

练习册系列答案
相关题目
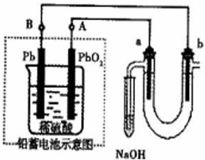 用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)
用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)| A、铅蓄电池负极的反应式为:Pb-2e-=Pb2+ |
| B、铅蓄电池放电时,B极质量减轻,A极质量增加 |
| C、铅蓄电池充电时,A极应与外电源负极相连 |
| D、电解苦卤水时,a电极首先放电的是Br- |
下列各组关于强电解质、弱电解质、非电解质的归类正确的是( )
| A | B | C | D | |
| 强电解质 | Fe | NaCl | BaSO4 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H2CO3 | Fe(OH)3 |
| 非电解质 | 蔗糖 | CaCO3 | C2H5OH | H2O |
| A、A | B、B | C、C | D、D |
下列实验设计和结论相符的是( )
A、加入NaOH溶液并加热,能产生使湿润红色石蕊试纸变蓝的气体,则一定含有N
| ||
| B、将SO2通入溴水,溴水褪色,说明SO2具有漂白性 | ||
| C、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- | ||
| D、在含FeCl2杂质的FeCl3溶液中通入足量Cl2后,充分加热除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
某固体混合物可能含有NH4Cl、KOH、AgNO3、AlCl3中的若干种,加适量水充分搅拌,得无色澄清溶液,取溶液进行如下实验:①蘸取少量原溶液滴在pH试纸上,试纸显蓝色,与标准比色卡比较,pH约为11;②取1mL原溶液加入3滴乙醛,水浴加热,试管内壁出现光亮的“银镜”.根据上述实验现象,以下推测正确的是( )
| A、肯定存在的只有KOH和AgNO3 |
| B、NH4Cl、AlCl3肯定不存在 |
| C、KOH和AlCl3可能存在 |
| D、肯定存在的只有NH4Cl、KOH和AgNO3 |
离子检验的常用方法有三种:下列离子检验的方法不合理的是( )
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
| A、NH4+:气体法 |
| B、SO42-:沉淀法 |
| C、H+:显色法 |
| D、Cl-:气体法 |
将纯水加热至较高温度,下列叙述正确的是( )
| A、水的离子积变大、pH变小、呈酸性 |
| B、水的离了积不变、pH不变、呈中性 |
| C、水的离子积变小、pH变大、呈碱性 |
| D、水的离子积变大、pH变小、呈中性 |
