题目内容
20.四氢铝锂(LiAlH4)是重要的有机合成试剂,其合成路线如下:
(1)反应1中,在通入氢气之前先通入Ar气的目的是作保护气.
(2)写出反应1的化学反应方程式:Na+Al+2H2=NaAlH4.
(3)为探究LiAlH4的性质,某实验小组将LiAlH4加入含乙二醇的水中,反应如下:LiAlH4+4H2O═LiOH+Al(OH)3+4H2↑,该反应的氧化剂为水(填化学式).
(4)为分离(3)中反应生成的两种沉淀(M).过程如下:
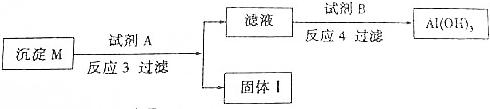
反应3的离子方程式是Al(OH)3+OH-=[Al(OH)4]-(填化学式),试剂B的最佳选择是CO2.
分析 在制四氢铝锂的流程中,在高温高压的条件下,氩气作保护气,Na、Al作还原剂,H2作氧化剂,发生氧化还原反应生成四氢铝锂(LiAlH4),四氢铝钠在乙醚溶剂中与氯化锂发生复分解反应生成四氢铝锂.
(1)LiH易与空气中的氧气发生反应;(2)Na、Al作还原剂,H2作氧化剂,发生氧化还原反应;(3)氧化还原反应中,氧化剂中元素化合价降低;
(4)分离(3)中反应生成的LiOH与Al(OH)3,根据Al(OH)3具有两性将它们分离.
解答 解:(1)LiH易与空气中的氧气发生反应,反应1中,在通入氢气之前先通入Ar气的目的是防止LiH与O2反应着火燃烧,Ar气作保护气,
故答案为:作保护气;(2)反应1的化学反应方程式:Na+Al+2H2=NaAlH4,故答案为:Na+Al+2H2=NaAlH4;(3)LiAlH4+4H2O═LiOH+Al(OH)3+4H2↑,该反应的氧化剂为水,故答案为:水;
(4)Al(OH)3具有两性,它与NaOH反应的离子方程式:Al(OH)3+OH-=[Al(OH)4]-,在滤液中通过量的CO2可得Al(OH)3,
故答案为:Al(OH)3+OH-=[Al(OH)4]-;CO2.
点评 本题考查知识点较多,涉及物质的分离、氧化还原反应、离子方程式的书写、元素化合物的性质等,属于拼合型题目,需要学生具备扎实的基础,难度中等.

练习册系列答案
相关题目
下列反应中,相关示意图错误的是( )
A | B | C | D |
将二氧化硫通入到一定量氯水中 | 将NaHCO3溶液滴入到一定量Ba(OH)2溶液中 | 将铜粉加入到一定量浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
|
|
|
|
5.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)830℃,在1L的固定容器的密闭容器中放入1mol CO和5mol H2O,反应达平衡后,其化学平衡常数K等于1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动.(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向(选填“正反应方向”、“逆反应方向”、“不移动”).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)830℃,在1L的固定容器的密闭容器中放入1mol CO和5mol H2O,反应达平衡后,其化学平衡常数K等于1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡.在其他条件不变的情况下,扩大容器的体积,平衡不移动.(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol•L-1、2mol•L-1、4mol•L-1、4mol•L-1,则此时上述反应的平衡移动方向为逆反应方向(选填“正反应方向”、“逆反应方向”、“不移动”).




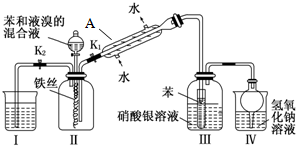
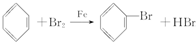

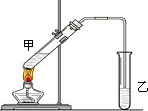 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: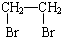 .
.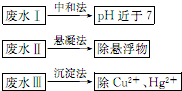 水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施.
水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施. 乙酸是食醋的主要成分,它的分子结构模型如图所示.
乙酸是食醋的主要成分,它的分子结构模型如图所示.