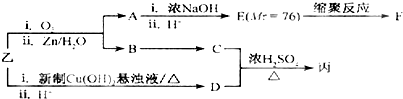
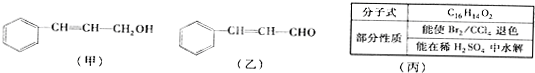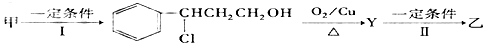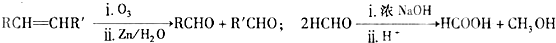题目内容
(1)9.5gMgCl2固体溶于水配成500mL溶液,其浓度为 mol?L-1,从中取出100mL溶液,其中Cl-的物质的量为 mol;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为 mol?L-1.
(2)标准状况下将aLNH3气体溶于1L水中,所得盐酸溶液的密度为bg?cm-3,该溶液物质的量浓度是 mol?L-1.
(2)标准状况下将aLNH3气体溶于1L水中,所得盐酸溶液的密度为bg?cm-3,该溶液物质的量浓度是
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)根据n=
计算氯化镁的物质的量,再根据c=
计算溶液物质的量浓度;根据c=nV计算氯离子物质的量;溶液是均匀的,从中取出100mL溶液的浓度与原溶液浓度相等,根据稀释定律计算稀释后溶液的浓度;
(2)根据n=
计算氨气的物质的量,再根据m=nM计算氨气的质量,溶液质量=气体质量+水的质量,利用V=
来计算溶液的体积,根据c=
计算该气体的物质的量浓度.
| m |
| M |
| n |
| V |
(2)根据n=
| V |
| Vm |
| m |
| ρ |
| n |
| V |
解答:
解:氯化镁的物质的量=
=0.1mol,溶液物质的量浓度=
=0.2mol/L;
取出100mL溶液,其中Cl-的物质的量为0.1L×0.2mol/L×2=0.04mol;
溶液是均匀的,从中取出100mL溶液的浓度与原溶液浓度相等,根据稀释定律,稀释后溶液的物质的量浓度=
=0.04mol/L,
故答案为:0.2;0.04;0.04;
(2)标准状况下,aL氨气的物质的量为
=
mol,
所以氨气的质量为
mol×17g/mol=
g,
所以溶液的质量为1000mL×1g/ml+
g=(1000+
)g,
所以溶液的体积为
=
L,
所以物质的量浓度为
=
mol/L,
故答案为:
.
| 9.5g |
| 95g/mol |
| 0.1mol |
| 0.5L |
取出100mL溶液,其中Cl-的物质的量为0.1L×0.2mol/L×2=0.04mol;
溶液是均匀的,从中取出100mL溶液的浓度与原溶液浓度相等,根据稀释定律,稀释后溶液的物质的量浓度=
| 100mL×0.2mol/L |
| 500mL |
故答案为:0.2;0.04;0.04;
(2)标准状况下,aL氨气的物质的量为
| aL |
| 22.4L/mol |
| a |
| 22.4 |
所以氨气的质量为
| a |
| 22.4 |
| 17a |
| 22.4 |
所以溶液的质量为1000mL×1g/ml+
| 17a |
| 22.4 |
| 17a |
| 22.4 |
所以溶液的体积为
(1000+
| ||
| 1000bg/L |
| 22400+17a |
| 22400b |
所以物质的量浓度为
| ||
|
| 1000ab |
| 22400+17a |
故答案为:
| 1000ab |
| 22400+17a |
点评:本题考查物质的量浓度计算,难度不大,注意对物质的量浓度定义的理解与灵活应用.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
下列分子中的中心原子杂化轨道的类型相同的是( )
| A、CO2与SO2 |
| B、BF3与NH3 |
| C、BeCl2与SCl2 |
| D、H2O与CH4 |