题目内容
17.下列热化学方程式书写正确的是(△H的绝对值均正确)( )| A. | Fe2O3+3CO═2Fe+3CO2△H=-24.8 kJ•mol-1(反应热) | |
| B. | CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1(反应热) | |
| C. | C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O(g)△H=-2 658.0 kJ•mol-1(燃烧热) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) |
分析 热化学方程式中需要注明物质的状态、焓变的正负号、焓变的数值及单位,且1mol纯物质燃烧生成稳定氧化物时放出的热量为燃烧热、中和反应生成1mol水时放出的热量为中和热,以此来解答.
解答 解:A.没有注明物质的状态,故A错误;
B.物质的状态、焓变均注明,书写合理,故B正确;
C.燃烧热中水应为液态,故C错误;
D.中和反应为放热反应,焓变为负,故D错误;
故选B.
点评 本题考查热化学方程式,为高频考点,把握热化学方程式中焓变、状态、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意中和热与燃烧热的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族.下列说法正确的是( )
| A. | 元素Y、W的简单阴离子具有相同的电子层结构 | |
| B. | 由X、W两种元素组成的化合物是离子化合物 | |
| C. | X的简单气态氢化物的热稳定性比W的弱 | |
| D. | 离子半径:r(Z)<r(Y)<r(X)<r(W) |
8.加热N2O5,依次发生分解反应:①N2O5(g)?N2O3(g)+O2(g)、②N2O3(g)?N2O(g)+O2(g).在体积为2L的恒容密闭容器中充入8mol N2O5,加热到T℃时O2和N2O3的物质的量分别为9mol、3.4mol,则T℃时$\frac{c({N}_{2}{O}_{3})•c({O}_{2})}{c({N}_{2}{O}_{5})}$为( )
| A. | 10.7 | B. | 8.5 | C. | 9.6 | D. | 10.2 |
5.将m g含Fe2O3•nH2O的Al2O3溶于200mL 0.05mol/L的硫酸溶液中,然后加入100mLNH3•H2O,使溶液的Fe3+和Al3+恰好完全沉淀,则NH3•H2O的浓度为( )
| A. | 0.2mol/L | B. | 0.1mol/L | C. | 0.05mol/L | D. | 0.02 mol/L |
2.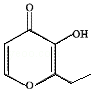 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H7O3 | |
| B. | 1mol该有机物最多能与2mol H2发生加成反应 | |
| C. | 该有机物能发生取代、加成和氧化反应 | |
| D. | 该有机物的一种含苯环的同分异构体能发生银镜反应 |
9.下列仪器能直接用酒精灯加热的是( )
①量筒 ②表面皿 ③烧杯 ④试管⑤容量瓶 ⑥蒸发皿 ⑦坩埚 ⑧烧瓶.
①量筒 ②表面皿 ③烧杯 ④试管⑤容量瓶 ⑥蒸发皿 ⑦坩埚 ⑧烧瓶.
| A. | ②③④⑥⑦⑧ | B. | ③⑥⑧ | C. | ④⑥⑦ | D. | ④⑦⑧ |
6.草酸(H2C2O4)与高锰酸钾在酸性条件下能够发生如下反应:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,【实验1】甲同学用8.00mL 0.001mol/L KMnO4溶液与5.00mL 0.01mol/L H2C2O4溶液反应,研究不同条件对化学反应速率的影响.改变的条件如表:
(1)如果研究温度对化学反应速率的影响,可用实验Ⅰ和Ⅱ作对比(用Ⅰ~III表示).
(2)对比实验Ⅰ和 III,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
| 组别 | KMnO4溶液 /ml | H2C2O4溶液 /ml | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 8.00 | 5.00 | 3.00 | 20 | |
| Ⅱ | 8.00 | 5.00 | 3.00 | 30 | |
| Ⅲ | 8.00 | 5.00 | 1.00 | 20 | 2.00mL 蒸馏水 |
(2)对比实验Ⅰ和 III,可以研究c(H+)(或硫酸溶液的浓度)对化学反应速率的影响,实验Ⅲ中加入2.00mL蒸馏水的目的是确保实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,可使Ⅰ和Ⅲ中硫酸浓度不同.
【实验2】乙同学在研究草酸与高锰酸钾在酸性条件下反应的影响因素时发现,草酸与酸性高锰酸钾溶液开始一段时间反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
(3)针对上述现象,乙同学认为草酸与高锰酸钾反应放热,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是催化剂的影响.
(4)若用实验证明你的猜想,除了酸性高锰酸钾溶液和草酸溶液外,还需要选择的试剂最合理的是D(填字母).
A.硫酸钾 B.水 C.二氧化锰 D.硫酸锰.
7.1-18号部分元素的主要信息见下表
(1)Z在元素周期表中的位置是第三周期IA族.
(2)Y、M、Z的原子半径由大到小的顺序为Na>S>F.(用元素符号表示)
(3)W单质燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)X与Y形成的化合物可用来雕刻玻璃,该反应的化学方程式为4HF+SiO2=SiF4↑+2H2O.
(5)设计实验比较Z和W的金属性强弱钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁.(指出实验中的操作、现象及结论)
(6)NT2常用于水的净化,工业上可用N的单质氧化NT2 -溶液制取NT2.写出该反应的离子反应方程式,并标出电子转移的方向和数目: .
.
(7)M的一种氧化物是一种常见的大气污染物,可用碱液来吸收.1L1mol/L的NaOH溶液最多能吸收该氧化物的体积为22.4L(标准状况).
| 元素代号 | X | T | Y | Z | W | M | N |
| 主要化合价 | +1 | -2 | -1 | +1 | +2 | +2、-2 | +7、-1 |
| 结构或用途 | 原子半径最小 | 地壳中含量最高的元素 | 非金属性最强 | 一种含氧化物可用作供氧剂 | 次外层电子数是最外层电子数的4倍 |
(2)Y、M、Z的原子半径由大到小的顺序为Na>S>F.(用元素符号表示)
(3)W单质燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(4)X与Y形成的化合物可用来雕刻玻璃,该反应的化学方程式为4HF+SiO2=SiF4↑+2H2O.
(5)设计实验比较Z和W的金属性强弱钠与冷水比镁与冷水反应剧烈,因此钠的金属性强于镁.(指出实验中的操作、现象及结论)
(6)NT2常用于水的净化,工业上可用N的单质氧化NT2 -溶液制取NT2.写出该反应的离子反应方程式,并标出电子转移的方向和数目:
 .
.(7)M的一种氧化物是一种常见的大气污染物,可用碱液来吸收.1L1mol/L的NaOH溶液最多能吸收该氧化物的体积为22.4L(标准状况).