题目内容
9.X、Y、Z、W是四种原子序数依次增大的短周期元素.已知:X与W位于同一主族,且W的原子序数是X的2倍,Z是同周期中简单离子半径最小的元素,Y的原子序数比Z小l.下列说法不正确的是( )| A. | Y、Z着火时均可用泡沫灭火器进行灭火 | |
| B. | 最高价氧化物对应水化物的碱性:Y>Z | |
| C. | Y、Z、W的简单离子都能促进水的电离 | |
| D. | 原子半径由小到大的顺序:X<W<Z<Y |
分析 X与W位于同一主族,且W的原子序数是X的2倍,则X为O,W为S元素,Z是同周期中简单离子半径最小的元素,应为Al,Y的原子序数比Z小l,应为Mg,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为O、Y为Mg、Z为Al,W为S,
A.Mg可在二氧化碳中燃烧,不能用泡沫灭火器进行灭火,故A错误;
B.金属性Mg>Al,元素的金属性越强,对应的最高价氧化物对应水化物的碱性越强,故B正确;
C.Y、Z、W的简单离子都可与水电离出的氢氧根离子或氢离子结合生成弱电解质,可促进水的电离,故C正确;
D.同周期元素从左到右原子半径逐渐减小,且核外电子层数越多,半径越大,故D正确.
故选A.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
19.下列图示与对应的叙述相符的是( )

| A. | 图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线) | |
| C. | 图3表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| D. | 图4表示水溶液中c(H+)和c(OH )的关系,在水中通适量KCl气体可从a点变到c点 |
20.下列说法中,正确的是( )
| A. | SO2能使FeCl3、酸性KMnO4溶液迅速褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 氨气和酸相遇都能产生白色烟雾 | |
| D. | 在反应NH3++H+=NH4+中,氨失去电子被氧化 |
17.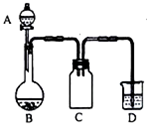 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
(1)写出Cu2O与混酸发生的反应的离子方程式:3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O.
(2)C装置的作用是防止D中溶液到吸入B中(或防倒吸).
(3)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气,吸收液与尾气发生反应的化学方程式为3NaClO+2NaOH+2NO═3NaCl+2NaNO3+H2O.
(4)制得的CuSO4溶液可能会含有Cu(NO3)2,为避免Cu(NO3)2的生成,在制备时应采取的措施是加入的硝酸不过量(或定量加入硝酸).
(5)某同学设计下列实验证明氢硫酸为二元弱酸,填写表中空白:
 实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:
实验室一般用回收的粗铜屑(含少量的Cu2O)与H2SO4、HNO3混合稀溶液反应制备CuSO4•5H2O晶体,反应可在如图所示装置中进行,回答下列问题:(1)写出Cu2O与混酸发生的反应的离子方程式:3Cu2O+2NO3-+14H+═6Cu2++2NO↑+7H2O.
(2)C装置的作用是防止D中溶液到吸入B中(或防倒吸).
(3)D装置中的NaClO-NaOH混合溶液用来吸收无色尾气,吸收液与尾气发生反应的化学方程式为3NaClO+2NaOH+2NO═3NaCl+2NaNO3+H2O.
(4)制得的CuSO4溶液可能会含有Cu(NO3)2,为避免Cu(NO3)2的生成,在制备时应采取的措施是加入的硝酸不过量(或定量加入硝酸).
(5)某同学设计下列实验证明氢硫酸为二元弱酸,填写表中空白:
| 实验一 证明H2S是弱酸 | 实验操作 | 取VmL未知浓度的H2S溶液,测其pH值为a,再向溶液中加入适量的无水CuSO4粉末,充分反应后再测其pH值为b,用过滤器将溶液中的不容物滤出,并用蒸馏水洗涤不容物,洗净,晾干并称量质量为m克. |
| 分析及结论 | 由实验中的数据可求得H2S溶液的物质的量浓度为:$\frac{1000m}{96V}$mol•L-1; 通过比较a和b数值的大小(或a>b)说明氢硫酸是弱酸. | |
| 实验原理 | 写出上述实验的化学反应方程式:CuSO4+H2S═CuS↓+H2SO4 | |
| 实验二 证明H2S是二元酸 | 实验操作 | 用已知浓度的NaOH溶液去滴定上述H2S溶液 |
| 分析及结论 | 通过实验若得出2n(H2S)=n(NaOH)(或消耗n(NaOH)为n(H2S)的二倍)即可说明H2S是二元酸 |
4.下列实验中红,对应的实验现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸测定等浓度的HCl、H2SO4两溶液的pH | 测定HCl溶液的pH试纸更红 | 非金属性Cl>S |
| B | 将AgCl和AgBr的饱和溶液等体积混合 | 出现淡黄色沉淀 | Ksp(AgBr)<Ksp(AgCl) |
| C | 向Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | A l(OH)3 不溶于氢氧化钡溶液 |
| D | 将Fe(NO3)2 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)3 样品溶于稀硫酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
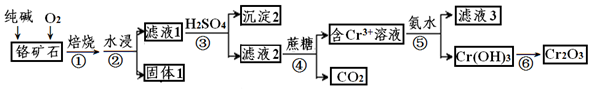
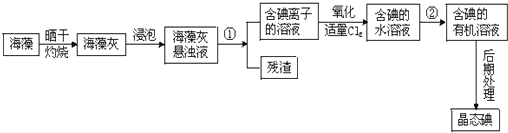
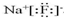 ,
, O2-
O2-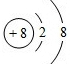 .
.