题目内容
在3BrF3+5H2O═HBrO3+Br2+9HF+O2↑中,若有5mol水做还原剂时,被水还原的BrF3的物质的量是( )
| A、3 mol | ||
| B、2 mo | ||
C、
| ||
D、
|
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用.根据氧化还原反应中电子转移守恒计算被水还原的BrF3的物质的量.
解答:
解:在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用.若5molH2O被氧化,氧原子提供电子物质的量为5mol×2,令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则:
5mol×2=xmol×(3-0)
解得x=
,
故选:D.
5mol×2=xmol×(3-0)
解得x=
| 10 |
| 3 |
故选:D.
点评:本题考查氧化还原反应的计算、氧化还原反应基本概念,为高频考点,侧重于学生的分析能力和计算能力的考查,难度中等,关键根据化合价判断氧化剂、还原剂,利用电子转移守恒计算.

练习册系列答案
相关题目
在下列各反应中,水既不作氧化剂也不作还原剂的氧化还原反应是( )
| A、2F2+2H2O═4HF+O2 |
| B、Na2O+H2O═2NaOH |
| C、2Na+2H2O═2NaOH+H2↑ |
| D、Cl2+H2O═HCl+HClO |
有机物R结构如图所示,下列说法正确的是( )
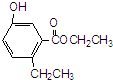

| A、R在碱性条件下的水解产物难溶于水 |
| B、R分子中有7种化学环境均不同的氢原子 |
| C、R和溴水反应后所得产物的化学式为C11H12O3Br2 |
| D、R不能使酸性高锰酸钾溶液褪色 |
为减缓足量的镁和一定量盐酸的反应速率,又不影响氢气的总量,可采用的措施是( )
| A、加固体NaOH |
| B、加固体硝酸钠 |
| C、加固体醋酸钾 |
| D、加硫酸 |
微型钮扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e=ZnO+H2O,Ag2O+H2O+2e=2Ag+2OH-,总反应为:Ag2O+Zn=2Ag+ZnO 根据上述反应式,判断下列叙述中,正确的是( )
| A、在使用过程中,电池负极区溶液pH值增大 |
| B、在使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C、Zn是负极,Ag2O是正极 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2mol/L,c(Al3+)为0.3mol/L.使Mg2+全部转化为沉淀分离出来,至少需加4mol/L NaOH溶液的体积为( )
| A、40 mL |
| B、72 mL |
| C、80 mL |
| D、128 mL |
下列叙述正确的是( )
| A、SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理不同 |
| B、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
| C、增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| D、用AgNO3溶液可以鉴别KCl和KI |
下列化学用语中,书写错误的是( )
A、硫离子的结构示意图: |
| B、次氯酸的结构式:H-O-Cl |
C、CO2的比例模型: |
D、丙烷的球棍模型: |