题目内容
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图1、图2)就能实现相应实验目的是( )
| 选项 | A | B | C | D |
| 实验项目 | 除去KCl中少量 的MnO2 | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 用氯化钠溶液制备氯化钠晶体 | 除去CO2气体中的HCl |
| 实验仪器 或装置 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 |  图1 | 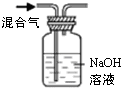 图2 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.除去KCl中的少量MnO2采用过滤的方法,过滤时用普通漏斗;
B.量取浓盐酸溶液时用量筒;
C.用NaCl溶液制取NaCl晶体采用蒸发的方法;
D.NaOH和CO2、HCl都反应.
B.量取浓盐酸溶液时用量筒;
C.用NaCl溶液制取NaCl晶体采用蒸发的方法;
D.NaOH和CO2、HCl都反应.
解答:
解:A.KCl易溶于水、MnO2不易溶于水,所以除去KCl中的少量MnO2采用过滤的方法,过滤时用普通漏斗而不是分液漏斗,故A错误;
B.浓盐酸的体积=
=1mL,量取浓盐酸溶液时用10mL量筒,故B错误;
C.加热时NaCl不分解,且随着温度的升高其溶解度变化不大,所以采用蒸发溶剂的方法从氯化钠溶液中获取NaCl晶体,故C正确;
D.NaOH和CO2、HCl都反应,所以不能用NaOH除去CO2气体中的HCl,应该用饱和的碳酸氢钠溶液,故D错误;
故选C.
B.浓盐酸的体积=
| 0.1mol/L×0.1L |
| 10mol/L |
C.加热时NaCl不分解,且随着温度的升高其溶解度变化不大,所以采用蒸发溶剂的方法从氯化钠溶液中获取NaCl晶体,故C正确;
D.NaOH和CO2、HCl都反应,所以不能用NaOH除去CO2气体中的HCl,应该用饱和的碳酸氢钠溶液,故D错误;
故选C.
点评:本题考查化学实验方案评价,涉及基本操作、物质的分离和除杂,明确基本实验规则、物质的性质即可解答,注意从实验操作的规范性、实验的可操作性、评价性等方面分析,注意B中选取的量筒和容量瓶应该注明规格,为易错点.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
在一定条件下,CO和CH4燃烧的热化学方程式为:CO(g)+1/2O2=CO2(g);△H=-283KJ/mol
CH4(g)+2O2=CO2(g)+2H2O(g);△H=-890KJ/mol,现有4mol CO和CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为2953KJ,则CO和CH4的体积比( )
CH4(g)+2O2=CO2(g)+2H2O(g);△H=-890KJ/mol,现有4mol CO和CH4组成的混合气体在上述条件下完全燃烧时,释放的热量为2953KJ,则CO和CH4的体积比( )
| A、1:3 | B、3:1 |
| C、1:2 | D、2:1 |
0.1mol?L-1的下列溶液碱性最强的是( )
| A、CH3COONa |
| B、Na2CO3 |
| C、NaCl |
| D、NaHCO3 |
如图试验中,所选装置不合理的是( )


| A、分离Na2CO3溶液和CH3COOC2H5,选④ |
| B、用CCl4提取碘水中的碘,选③ |
| C、用FeCl2溶液吸收Cl2选⑤ |
| D、粗盐提纯,选①和② |
在一定温度下,下列不是可逆反应A(g)+3B(g)?2C(g)达到平衡标志的为( )
| A、C生成速率与C分解速率相等 |
| B、单位时间内生成a molA,同时生成3a molB |
| C、A、B、C的浓度保持一定不变 |
| D、A、B、C的压强不再变化 |
下列说法不正确的是( )
| A、溴化银是重要感光材料,可用于人工降雨 |
| B、氯水用于漂白表现了HClO的强氧化性 |
| C、漂白粉的有效成分是次氯酸钙 |
| D、钠和钾的合金,可用于快中子反应堆作热交换剂 |