题目内容
下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知D为金属单质,其他为化合物.在G中加入试剂②生成H时,生成的固体颜色的变化是先由白色变灰绿,最终为红褐色.

写出下列反应的方程式:
C→F的离子方程式 . H→I的化学方程式 .

写出下列反应的方程式:
C→F的离子方程式
考点:无机物的推断
专题:推断题
分析:铝与氧化铁反应生成Fe与Al2O3,D与试剂①得到G,在G中加入试剂②生成H时,生成的固体颜色的变化是先由白色变灰绿,最终为红褐色,则D为Fe、B为Fe2O3,试剂①为酸,试剂②为碱,G为亚铁盐,H为Fe(OH)2,I为Fe(OH)3.C为Al2O3,能与试剂①得到E,则E为铝盐,C与试剂②得到F,F与试剂①得到E,故F为偏铝酸盐,据此解答.
解答:
解:铝与氧化铁反应生成Fe与Al2O3,D与试剂①得到G,在G中加入试剂②生成H时,生成的固体颜色的变化是先由白色变灰绿,最终为红褐色,则D为Fe、B为Fe2O3,试剂①为酸,试剂②为碱,G为亚铁盐,H为Fe(OH)2,I为Fe(OH)3.C为Al2O3,能与试剂①得到E,则E为铝盐,C与试剂②得到F,F与试剂①得到E,故F为偏铝酸盐,则:
C→F的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
H→I的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:Al2O3+2OH-=2AlO2-+H2O;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
C→F的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
H→I的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:Al2O3+2OH-=2AlO2-+H2O;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评:本题考查无机物推断,涉及Fe、Al元素单质化合物性质,“B的颜色及铝与氧化铁的反应”是推断突破口,侧重对化学用语的考查,难度不大,注意基础知识的掌握.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
下列实验设计和结论相符的是( )
| A、将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热煮沸,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| C、某无色溶液中加Ba(NO3)2溶液,再加稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| D、某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |
物质的量浓度相同的下列溶液,由水电离出的c(H+)由大到小的顺序是( )
①KHSO4 ②K2SO4 ③K2CO3 ④KHCO3.
①KHSO4 ②K2SO4 ③K2CO3 ④KHCO3.
| A、④③②① | B、③④②① |
| C、③②④① | D、①②③④ |
有A、B两种短周期元素,原子半径是:r(A)<r(B),且A、B两种元素原子的最外层电子数相同(选项中的m、n均为正整数),下列说法正确的是( )
| A、若B(OH)m 是强碱,则A(OH)m一定为强碱 |
| B、若HnAOm是强酸,则B的最高价氧化物对应的水化物一定为强酸 |
| C、若B是金属,则A可能是非金属,若B是非金属,则A可能是金属 |
| D、常温下,若B元素的氢化物是气体,则A元素的氢化物可能是液体 |
下列两种气体的分子数一定不相等的是( )
| A、质量相等密度不等的N2和C2H4 |
| B、等体积等密度的CO和C2H4 |
| C、等温、等压,等体积的O2和N2 |
| D、标准状况下,等质量的NO和CO |
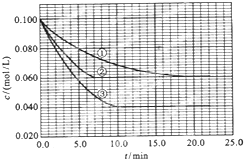 在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200MOL/l及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200MOL/l及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.