题目内容
在高温下,下列反应达到平衡:C(s)+H2O(g)?CO(g)+H2(g) (正反应为吸热反应)
(1)如果升高温度,平衡向 反应方向移动(填正或逆);
(2)如果增大压强,H2的体积分数将 (填增大、减小或不变);
(3)如果通入水蒸汽,平衡向 反应方向移动(填正或逆);
(4)如果加入焦炭,H2O的转化率将 (填增大、减小或不变).
(1)如果升高温度,平衡向
(2)如果增大压强,H2的体积分数将
(3)如果通入水蒸汽,平衡向
(4)如果加入焦炭,H2O的转化率将
考点:化学平衡的影响因素
专题:化学平衡专题
分析:化学反应的特征是反应前后气体体积增大的吸热反应,依据化学平衡移动原理分析判断;
解答:
解:在高温下,下列反应达到平衡:C(s)+H2O(g)═CO(g)+H2(g)(正反应为吸热反应);
(1)如果升高温度,平衡向吸热反应方向进行,所以平衡正向进行;
故答案为:正;
(2)增大压强平衡向气体体积减小的方向进行,平衡逆向进行,H2的体积分数减小;
故答案为:减小;
(3)增大水蒸气浓度,增大反应物浓度平衡正向进行;
故答案为:正;
(4)如果加入焦炭是固体,固体不影响平衡,H2O的转化率不变;
故答案为:不变;
(1)如果升高温度,平衡向吸热反应方向进行,所以平衡正向进行;
故答案为:正;
(2)增大压强平衡向气体体积减小的方向进行,平衡逆向进行,H2的体积分数减小;
故答案为:减小;
(3)增大水蒸气浓度,增大反应物浓度平衡正向进行;
故答案为:正;
(4)如果加入焦炭是固体,固体不影响平衡,H2O的转化率不变;
故答案为:不变;
点评:本题考查了化学平衡影响因素的分析判断,化学平衡移动原理是解题关键,题目较简单.

练习册系列答案
相关题目
瓦斯是矿井常见易爆炸的气体,其中的甲烷和氧气的体积比为1:2时爆炸最为猛烈,此时甲烷与氧气的质量比为( )
| A、1:4 | B、1:2 |
| C、1:1 | D、2:1 |
“神舟六号”的成功发射和返回,第一次实现了我国有人参与的空间科学实验.整个飞船应用了许多尖端的合成材料.下列物质中,不属于合成材料的是( )
| A、人造丝 | B、有机玻璃 |
| C、硅橡胶 | D、黏合剂 |
氯碱工业的一种节能新工艺,将电解池与燃料电池相组合,相关物料的传输与转化关系如图所示(电极未标出):

下列说法正确的是( )

下列说法正确的是( )
| A、电解池的阴极反应式为H++2e-=H2↑ |
| B、通入空气的电极为负极 |
| C、电解池中产生2mol Cl2,理论上燃料电池中消耗0.5 mol O2 |
| D、a、b、c的大小关系为:a>b=c |
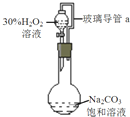 过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验:
过碳酸钠是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,化学式可表示为aNa2CO3?bH2O2,具有Na2CO3和H2O2的性质.某化学兴趣小组进行如下实验: