题目内容
17.某化学课外小组为了探究卤素单质及化合物的性质,选用以下仪器和药品进行实验,请你帮助完成实验仪器的组装并回答问题.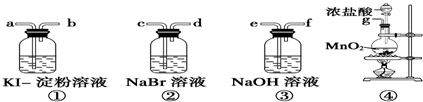
(1)比较卤素单质的氧化性强弱,各仪器的正确连接顺序(填各接口的字母符号)
g接c,d接a,b接e.
(2)装置④烧瓶中反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)装置①中的现象是溶液变蓝色,装置③的作用是吸收剩余Cl2.
(4)装置②中反应的离子方程式为Cl2+2Br-═Br2+2Cl-.
(5)向反应后的①中加入足量的NaOH溶液,产生的现象是蓝色褪去,反应的方程式是I2+2NaOH═NaI+NaIO+H2O.
分析 (1)比较卤素单质的氧化性强弱,首先制备氯气,再把氯气通过NaBr溶液和KI-淀粉溶液,最后通过尾气处理装置;
(2)装置④烧瓶中二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水;
(3)装置①中氯气与碘化钾反应生成单质碘;氢氧化钠溶液用于吸收多余的氯气;
(4)装置②中氯气与溴化钠溶液反应生成氯化钠和单质溴;
(5)在碘溶液中加NaOH溶液会生成NaI和NaIO.
解答 解:(1)比较卤素单质的氧化性强弱,装置④烧瓶中二氧化锰与浓盐酸反应生成氯气,再把氯气通过NaBr溶液,与溴化钠反应生成氯化钠和单质溴,氯气再通过KI-淀粉溶液生成单质碘,最后通过盛有氢氧化钠溶液的装置吸收多余的氯气,所以各仪器的正确连接顺序为g-c-d-a-b-e;
故答案为:c、d、a、b、e;
(2)装置④烧瓶中二氧化锰与浓盐酸在加热条件下生成氯化锰、氯气和水,其反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)装置①中氯气与碘化钾反应生成单质碘,碘使淀粉溶液变蓝色;氯气属于有毒气体会污染环境,所以要用氢氧化钠溶液用于吸收多余的氯气;
故答案为:溶液变蓝色;吸收剩余Cl2;
(4)装置②中氯气与溴化钠溶液反应生成氯化钠和单质溴,其反应的离子方程式为:Cl2+2Br-═Br2+2Cl-;
故答案为:Cl2+2Br-═Br2+2Cl-;
(5)反应后的①溶液为单质碘的溶液,在碘溶液中加NaOH溶液会生成NaI和NaIO,其反应方程式为:I2+2NaOH═NaI+NaIO+H2O,所以溶液蓝色会褪去;
故答案为:蓝色褪去;I2+2NaOH═NaI+NaIO+H2O.
点评 本题考查实验方案的设计,题目难度中等,熟悉氯气的制取原理及物质的性质是解答本题的关键,注意发生的氧化还原反应为解答的难点,试题培养了学生的分析能力及化学实验能力.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
(2)S原子结构示意图为
 ;
;(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是HClO4(填化学式);
(4)C、N和O原子半径由小到大的顺序的是O<N<C;
(5)第3周期中气态氢化物最稳定的是HCl;
(6)Si是带来人类文明的重要元素之一,其氧化物化学式是SiO2;
(7)铝是大自然赐予人类的宝物.它的一个用途是发生铝热反应,冶炼某些难熔金属,写出该反应的一个化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3
(8)N元素形成的氢化物是NH3,它和HCl相遇后的现象是有白烟产生.
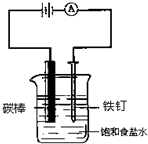
| A. | 碳酸镁 | B. | 硫酸钡 | C. | 氢氧化镁 | D. | 碳酸钡 |
| A. | 甲烷 | B. | 乙烯 | C. | 苯 | D. | 乙炔 |
| A. | 氢 | B. | 氮 | C. | 氧 | D. | 硅 |
| 选项 | 现象 | 解释 |
| A | Cl2在H2中点燃,瓶口有白雾 | 生成HCl极易溶于水 |
| B | 饱和Na2CO3溶液中通入CO2析出白色晶体 | 生成NaHCO3溶解度小析出 |
| C | 常温下将铝片放入浓硝酸中无明显变化 | Al和浓硝酸不反应 |
| D | SO2通入溴水,溴水褪色 | SO2具有还原性. |
| A. | A | B. | B | C. | C | D. | D |

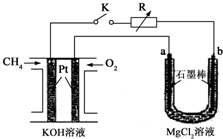 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.请回答下列问题: