题目内容
如图1是氯碱工业的流程及产物的部分转化关系,其中A、B、C、D、E分别表示一种或多种物质.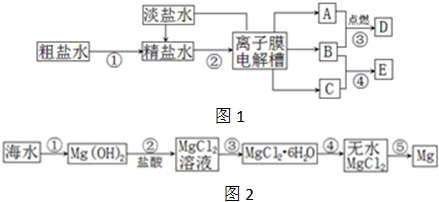
请回答下列问题:
(1)离子膜电解槽中发生反应的化学方程式为: .
(2)C产生在离子膜电解槽的 (填“阴极室”或“阳极室”),写出A的一种用途 .
(3)反应④的离子方程式为: .
(4)粗盐水中含有泥沙、Ca2+、Mg2+、SO42-等杂质,必须除去杂质后使用.已知:KSP[Mg(OH)2]=5.61×10-12; KSP[MgCO3]=6.82×10-6,为了尽可能除去Mg2+,你选用纯碱还是烧碱: ; 粗盐水精制的过程中可能用到①盐酸、②烧碱、③纯碱、④氯化钡、⑤过滤,添加试剂及操作的合理顺序是 (填序号).
(5)氯碱工业的产品都有广泛的用途.如图2是从海水中提取镁的流程,其中步骤③的操作是 ,步骤④需要用到D,原因是 .

请回答下列问题:
(1)离子膜电解槽中发生反应的化学方程式为:
(2)C产生在离子膜电解槽的
(3)反应④的离子方程式为:
(4)粗盐水中含有泥沙、Ca2+、Mg2+、SO42-等杂质,必须除去杂质后使用.已知:KSP[Mg(OH)2]=5.61×10-12; KSP[MgCO3]=6.82×10-6,为了尽可能除去Mg2+,你选用纯碱还是烧碱:
(5)氯碱工业的产品都有广泛的用途.如图2是从海水中提取镁的流程,其中步骤③的操作是
考点:物质分离和提纯的方法和基本操作综合应用,无机物的推断
专题:实验设计题
分析:图1中粗盐水经分离、提纯得到精盐水,电解生成氢气、氯气和氢氧化钠,由A和B反应以及B和C的反应可知A为H2,B为Cl2,C为NaOH,则D为HCl,E为NaCl和NaClO混合物;
图2海水经浓缩后加入氧化钙可生成氢氧化镁沉淀,氢氧化镁和盐酸反应生成氯化镁,结晶生成氯化镁晶体,在盐酸酸性环境中蒸发结晶生成氯化镁,电解熔融的氯化镁可生成镁,以此解答该题.
图2海水经浓缩后加入氧化钙可生成氢氧化镁沉淀,氢氧化镁和盐酸反应生成氯化镁,结晶生成氯化镁晶体,在盐酸酸性环境中蒸发结晶生成氯化镁,电解熔融的氯化镁可生成镁,以此解答该题.
解答:
解:(1)电解氯化钠溶液生成氢气、氯气和氢氧化钠,方程式为2NaCl+2H2O
Cl2↑+H2↑+2NaOH,故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH;
(2)C为氢氧化钠,在电解槽的阴极生成,A为氢气,可用作燃料等,故答案为:阴极室;做燃料;
(3)反应④为氯气与氢氧化钠溶液的反应,方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)已知:KSP[Mg(OH)2]=5.61×10-12; KSP[MgCO3]=6.82×10-6,说明Mg(OH)2溶解度更小,为了尽可能除去Mg2+,应生成Mg(OH)2,则加入烧碱,要除去粗盐中含有的杂质,可以加过量的氯化钡溶液除去硫酸镁,加过量的NaOH溶液除去镁离子,加过量的Na2CO3溶液除去氯化钙,通过过滤把不溶于水的物质除去,加适量的盐酸除去过量的氢氧化钠和碳酸钠,为保证杂质全部除去,所加试剂要过量,且碳酸钠放在氯化钡后面加,这样碳酸钠既可以除去杂质还可以除去过量的钡离子,盐酸加在最后,除去氢氧根离子以及过量的碳酸根离子,顺序为;④②③⑤①或④③②⑤①或②④③⑤①,
故答案为:烧碱;④②③⑤①或④③②⑤①或②④③⑤①;
(5)图2海水经浓缩后加入氧化钙可生成氢氧化镁沉淀,氢氧化镁和盐酸反应生成氯化镁,结晶生成氯化镁晶体,在盐酸酸性环境中蒸发结晶生成氯化镁,防止MgCl2?H2O水解,无法得到MgCl2,电解熔融的氯化镁可生成镁,则步骤③的操作是蒸发结晶,
故答案为:蒸发结晶;防止MgCl2?H2O水解,无法得到MgCl2.
| ||
| ||
(2)C为氢氧化钠,在电解槽的阴极生成,A为氢气,可用作燃料等,故答案为:阴极室;做燃料;
(3)反应④为氯气与氢氧化钠溶液的反应,方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)已知:KSP[Mg(OH)2]=5.61×10-12; KSP[MgCO3]=6.82×10-6,说明Mg(OH)2溶解度更小,为了尽可能除去Mg2+,应生成Mg(OH)2,则加入烧碱,要除去粗盐中含有的杂质,可以加过量的氯化钡溶液除去硫酸镁,加过量的NaOH溶液除去镁离子,加过量的Na2CO3溶液除去氯化钙,通过过滤把不溶于水的物质除去,加适量的盐酸除去过量的氢氧化钠和碳酸钠,为保证杂质全部除去,所加试剂要过量,且碳酸钠放在氯化钡后面加,这样碳酸钠既可以除去杂质还可以除去过量的钡离子,盐酸加在最后,除去氢氧根离子以及过量的碳酸根离子,顺序为;④②③⑤①或④③②⑤①或②④③⑤①,
故答案为:烧碱;④②③⑤①或④③②⑤①或②④③⑤①;
(5)图2海水经浓缩后加入氧化钙可生成氢氧化镁沉淀,氢氧化镁和盐酸反应生成氯化镁,结晶生成氯化镁晶体,在盐酸酸性环境中蒸发结晶生成氯化镁,防止MgCl2?H2O水解,无法得到MgCl2,电解熔融的氯化镁可生成镁,则步骤③的操作是蒸发结晶,
故答案为:蒸发结晶;防止MgCl2?H2O水解,无法得到MgCl2.
点评:本题考查了海水资源的综合利用,为高频考点,侧重于学生的分析能力和实验能力的考查,体现化学来源于生产、生活,又服务于生产、生活的理念,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化合物不属于烃类的是( )
| A、C2H4O2 |
| B、C4H10 |
| C、C2H4 |
| D、C20H40 |
下列实验操作中正确的是( )
| A、配制一定物质的量浓度的硫酸溶液时.只需使用1次玻璃棒 |
| B、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C、蒸馏操作时,应使温度计水银球插入液面以下 |
| D、碘水不可用于鉴别苯、四氯化碳、乙醇三种无色液体 |
有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3,有四位同学为鉴别它们,采用了以下不同方法,其中可行的是( )
| A、分别配成溶液,再通入CO2 |
| B、分别配成溶液,再加入Ca(OH)2溶液 |
| C、分别加热,用澄清石灰水检验是否有气体产生 |
| D、分别配成溶液,再进行焰色反应 |
下列各组微粒在溶液中能大量共存的是( )
| A、Al3+、K+、Cl-、OH- |
| B、Na+、H+、SO42-、HCO3- |
| C、Mg2+、Fe3+、H+、Cl- |
| D、Ag+、Na+、Cu2+、Cl- |