题目内容
6. 如图为某种燃料电池的工作原理示意图,a、b 均为惰性电极.
如图为某种燃料电池的工作原理示意图,a、b 均为惰性电极.①使用时,空气从B口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a 极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O.
分析 由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,以此解答该题.
解答 解:①由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,故答案为:B;
②假设使用的“燃料”是甲醇,a极为负极,发生的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,b为正极,发生还原反应,电极方程式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
点评 本题考查的知识点较多,题目综合性较强,难度较大,主要考查了燃料电池的电极的判断和电极反应式的书写等,在书写电池的电极方程式时要注意电解质对反应产物的影响.

练习册系列答案
相关题目
16.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的最高价氧化物对应的水化物与其氢化物反应生成离子化合物;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)A元素在周期表中的位置是第二周期第VA族.
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题
有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=3NaOH+NH3•H2O.
(4)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子释放在空气中可能引起的环境问题
有:酸雨(或光化学烟雾)(任写一种).
(3)A和C组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是Na3N+4H2O=3NaOH+NH3•H2O.
(4)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(5)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(6)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol

(7)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
14.可以肯定溶液中存在大量SO42-的理由是( )
| A. | 加入AgNO3溶液,有白色沉淀产生 | |
| B. | 加入稀盐酸溶液,无明显现象,再加入BaCl2溶液,产生白色沉淀 | |
| C. | 加入Ba(NO3)2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解 | |
| D. | 加入BaCl2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解 |
1.下列叙述正确的是( )
| A. | 电解氯化镁溶液来制取镁 | |
| B. | 钠加入氯化镁的饱和溶液中可以制取金属镁 | |
| C. | 电解冶炼铝的原料是氯化铝 | |
| D. | 工业上用电解熔融氯化钠的方法制取钠 |
15.在密闭容器中A与B反应生成C,其反应速为2$\overline v$(B)=3$\overline v$(A),$\overline v$(C)=$\overline v$(B),则此反应可表示为( )
| A. | 2A+3B?2C | B. | 2A+3B?3C | C. | 3A+2B?3C | D. | 3A+2B?2C |
16.规范的操作是实验成功的保证.下列实验操作正确的是( )
| A. |  CO2验满 | B. |  收集O2 | C. |  滴加液体 | D. |  测溶液pH |

 .
.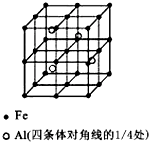 一种Al-Fe合金的立体晶胞结构如图,请据此回答下列问题:
一种Al-Fe合金的立体晶胞结构如图,请据此回答下列问题: