题目内容
14.过氧化钠可作为氧气的来源,常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )| 选项 | 二氧化碳 | 碳酸钠 | 转移的电子 |
| A | lmol | 2NA | |
| B | 22.4L | lmol | |
| C | 106g | lmol | |
| D | 106g | 2NA |
| A. | A | B. | B | C. | C | D. | D |
分析 由化学方程式:2Na2O2+2CO2═2Na2CO3+O2,根据质量差求出二氧化碳、碳酸钠的物质的量,进而求出碳酸钠的质量和转移的电子数.
解答 解:二氧化碳和过氧化钠反应,当固体质量增加28g时,设参与反应二氧化碳的物质的量为x,生成碳酸钠的物质的量为y,
2Na2O2+2CO2═2Na2CO3+O2 固体质量差
2mol 2mol 56g
x y 28g
$\frac{2mol}{x}$=$\frac{56g}{28g}$
解得:x=1mol,
$\frac{2mol}{y}$=$\frac{56g}{28g}$
解得y=1mol,
碳酸钠的质量=1mol×106g/mol=106g,
因常温常压下发生的反应,1mol二氧化碳的体积>22.4L;
由化学方程式可知;1mol二氧化碳参与反应转移1mol电子,即有 NA个电子转移;
故选C.
点评 本题主要考查化学方程式的书写、有关化学方程式的计算以及氧化还原反应中电子转移数目的计算,为高频考点,侧重于考查学生的计算能力,题目难度中等,答题时注意把握反应的特点,把握化合价的变化以及差量法的运用.

练习册系列答案
相关题目
4.设NA表示阿伏加德罗常数,下列关于0.2mol•L-1的BaCl2溶液中说法不正确的是( )
| A. | 2 L溶液中Ba2+和Cl-的总数为0.8NA | |
| B. | 500 mL溶液中Cl-的浓度为0.2 mol•L-1 | |
| C. | 500 mL溶液中Ba2+的浓度为0.2 mol•L-1 | |
| D. | 500 mL溶液中Cl-的总数为0.2NA |
5.一种镁原电池的反应为xMg+Mo3S4=Mgx Mo3S4;在镁原电池放电时,下列说法错误的是( )
| A. | Mg2+向正极迁移 | |
| B. | 正极反应为:Mo3S4+2xe-═Mo3S${\;}_{4}^{2{x}^{-}}$ | |
| C. | Mo3S4发生氧化反应 | |
| D. | 负极反应为:xMg-2xe-═xMg2+ |
9.下列关于各种消毒剂的使用方法中,恰当的是( )
| A. | 漂白粉、漂粉精可用于饮用水及餐具等的消毒 | |
| B. | 福尔马林可用于食品的消毒,如浸泡海鲜,使其不易变质 | |
| C. | 药用酒精可用于食物及饮用水消毒 | |
| D. | 过氧乙酸无须稀释可直接使用消毒,不会对人体造成伤害 |
6.关于电解NaCl水溶液,下列叙述正确的是( )
| A. | 若在阴极附近的溶液中滴入紫色石蕊试液,溶液呈红色 | |
| B. | 若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 | |
| C. | 电解时在阳极得到氯气,在阴极得到金属钠 | |
| D. | 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液变回NaCl溶液 |
3.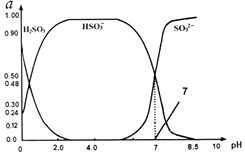 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
 常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )
常温下0.1mol•L-1亚硫酸溶液中 H2SO3、HSO3-、SO32-三种微粒所占物质的量分数(a)随pH变化的关系如图所示.下列说法不正确的是( )| A. | 由图中数据可计算得到常温下亚硫酸溶液的Ka2 | |
| B. | 在0.1mol•L-1H2SO3溶液中,存在:c2(H+)=c(H+)•c(HSO3-)+2c(H+)•c(SO32-)+Kw | |
| C. | 向pH为7的溶液中滴入少量稀盐酸造成的溶液pH变化小于向pH为4.0的溶液中滴入相同量稀盐酸造成的溶液pH变化 | |
| D. | 在pH=2.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-) |
4.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子是Ar
(2)地壳中含量最多的金属元素是Al;非金属性最强的元素F
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.①的最高价氧化物对应的水化物的化学式为HNO3,其稀溶液与铜反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.当有0.4mol该物质被还原,则转移的电子为0.3mol.
(5)①、②、③所形成的气体氢化物的稳定性由强到弱的顺序HF>H2O>NH3
(6)完成下列反应的化学方程式:⑦的氧化物与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O,④、⑥的最高价氧化物对应的水化物两两反应:Al(OH)3+NaOH=NaAlO2+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 四 | ⑩ |
(2)地壳中含量最多的金属元素是Al;非金属性最强的元素F
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)在这些元素中,原子半径最小的是F,原子半径最大的是K.①的最高价氧化物对应的水化物的化学式为HNO3,其稀溶液与铜反应的化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.当有0.4mol该物质被还原,则转移的电子为0.3mol.
(5)①、②、③所形成的气体氢化物的稳定性由强到弱的顺序HF>H2O>NH3
(6)完成下列反应的化学方程式:⑦的氧化物与氢氧化钠溶液反应SiO2+2NaOH=Na2SiO3+H2O,④、⑥的最高价氧化物对应的水化物两两反应:Al(OH)3+NaOH=NaAlO2+2H2O.
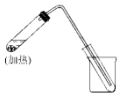 如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题:
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同.回答下列问题: