题目内容
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究.在25℃时,弱酸HA在水中部分电离,HA的电离度为0.20;在苯中部分发生双聚,生成(HA)2.该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=c(HA)B/c(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;已知:lg2≈0.3,lg3≈0.5.其他信息如下:
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1= .
(2)25℃,该水溶液的pH为 ,在苯体系中HA的转化率为 .
(3)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
=130,则反应向 方向进行.(填“正反应”、“逆反应”或“不移动”)
(4)在苯中,HA发生二聚:2HA?(HA)2,反应在较低温度下自发进行,则△H2 0(填“>”、“<”或“=”).已知该二聚反应的反应热数值约为活化能的
.下列能量关系图最合理的是 .

(5)下列有关该混合体系说法不正确的是 .
A.用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,则上述平衡均正移,且c(HA)均减小
B.升高温度,HA的电离平衡常数K1和2HA?(HA)2的平衡常数K2均变大
C.若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度
D.在25℃时,若再加入一定量的HA固体,则水和苯中HA的起始总浓度之比仍为3:4
(6)在25℃时,用0.1000mol/L氢氧化钠溶液滴定20.00mL 0.1000mol/L HA水溶液,请在下图中画出滴定曲线示意图.

| 25℃平衡体系(苯、水、HA) | 平衡常数 | 焓变 | 起始总浓度 |
| 在水中,HA?H++A- | K1 | △H1 | 3.0×10-3 mol?L-1 |
| 在苯中,2HA?(HA)2 | K2 | △H2 | 4.0×10-3 mol?L-1 |
(1)计算25℃时水溶液中HA的电离平衡常数K1=
(2)25℃,该水溶液的pH为
(3)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
| c[(HA)2] |
| c2(HA) |
(4)在苯中,HA发生二聚:2HA?(HA)2,反应在较低温度下自发进行,则△H2
| 5 |
| 9 |

(5)下列有关该混合体系说法不正确的是
A.用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,苯溶液中加少量苯,则上述平衡均正移,且c(HA)均减小
B.升高温度,HA的电离平衡常数K1和2HA?(HA)2的平衡常数K2均变大
C.若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度
D.在25℃时,若再加入一定量的HA固体,则水和苯中HA的起始总浓度之比仍为3:4
(6)在25℃时,用0.1000mol/L氢氧化钠溶液滴定20.00mL 0.1000mol/L HA水溶液,请在下图中画出滴定曲线示意图.

考点:化学平衡的计算,反应热和焓变,中和滴定
专题:化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:(1)根据HA的电离度及初始浓度计算出25℃时溶液中c(A-)、c(H+)及c(HA),再根据电离平衡常数表达式计算出HA的电离平衡常数;
(2)根据溶液中氢离子浓度计算出溶液的pH;根据K=c(HA)B/c(HA)W=1.0及HA在水溶液中的物质的量浓度计算出苯体系中HA的转化率;
(3)计算出该温度下苯条件下中的平衡常数,然后
=130与平衡常数进行比较,若大小平衡常数,说明平衡向着逆反应方向移动,否则向着正反应方向移动;
(4)由反应来分析△S<0,再利用△H-T△S<0来分析有利于该反应自发进行判断反应的焓变;根据焓变及活化能与反应热数值判断图象正误;
(5)A、水溶液中促进了电离,平衡向着正向移动,苯体系中平衡向着分子数增大的方向移动;
B、弱电解质的电离为吸热反应,而在苯中HA发生二聚反应2HA?(HA)2为放热方向,温度对平衡常数影响不同;
C、用酸碱中和滴定的方法,可以测出HA的起始总浓度;
D、在饱和溶液中水和苯中HA的起始总浓度之比为3:4,否则不是;
(6)加入氢氧化钠溶液体积为0时,0.1000mol/L HA的溶液中氢离子浓度为0.02mol/L,计算出此时的pH;当加入氢氧化钠溶液体积为20mL时二者恰好反应,图象中出现突变区间,据此画出滴定曲线示意图.
(2)根据溶液中氢离子浓度计算出溶液的pH;根据K=c(HA)B/c(HA)W=1.0及HA在水溶液中的物质的量浓度计算出苯体系中HA的转化率;
(3)计算出该温度下苯条件下中的平衡常数,然后
| c[(HA)2] |
| c2(HA) |
(4)由反应来分析△S<0,再利用△H-T△S<0来分析有利于该反应自发进行判断反应的焓变;根据焓变及活化能与反应热数值判断图象正误;
(5)A、水溶液中促进了电离,平衡向着正向移动,苯体系中平衡向着分子数增大的方向移动;
B、弱电解质的电离为吸热反应,而在苯中HA发生二聚反应2HA?(HA)2为放热方向,温度对平衡常数影响不同;
C、用酸碱中和滴定的方法,可以测出HA的起始总浓度;
D、在饱和溶液中水和苯中HA的起始总浓度之比为3:4,否则不是;
(6)加入氢氧化钠溶液体积为0时,0.1000mol/L HA的溶液中氢离子浓度为0.02mol/L,计算出此时的pH;当加入氢氧化钠溶液体积为20mL时二者恰好反应,图象中出现突变区间,据此画出滴定曲线示意图.
解答:
(1)在25℃时,弱酸HA在水中部分电离,HA的电离度为0.20,则溶液中电离的HA的物质的量浓度为:3.0×10-3 mol?L-1×0.2=6.0×10-4 mol?L-1,电离的c(A-)=c(H+)=6.0×10-4 mol?L-1,没有电离的HA的物质的量浓度为:3.0×10-3 mol?L-1×(1-0.2)=2.4×10-3 mol?L-1,25℃时水溶液中HA的电离平衡常数K1=
=1.5×10-4,
故答案为:1.5×10-4;
(2)由(1)可知,溶液中氢离子浓度为:c(H+)=6.0×10-4 mol?L-1,该溶液的pH=-lgc(H+)=-lg6.0×10-4=4-lg6=4-lg2-lg3=4-0.3-0.5=3.2;
水中HA的物质的量浓度为:3.0×10-3mol?L-1×0.8=2.4×10-3mol?L-1,由于以分子形式存在的HA在苯和水两种溶剂中的比例为1:1,所以苯体系中HA的浓度为2.4×10-3mol?L-1,发生转化的HA的物质的量浓度为:(4.0×10-3-2.4×10-3)mol/L=1.6×10-3mol?L-1,在苯体系中HA的转化率为:
×100%=40%,
故答案为:3.2;40%;
(3)在苯中反应2HA?(HA)2的平衡常数为:K=
≈138.9,由于
=130<K,平衡向着正反应方向移动,
故答案为:正反应;
(4)由反应2HA?(HA)2可知,2mol反应物参加反应时生成1mol生成物,则△S<0,再由△H-T△S<0有利于该反应自发进行,且该反应在较低温度下自发进行,所以△H<0;
故答案为:<;B;
(5)A、用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,浓度越小,电离程度越大,则上述平衡正移,且c(HA)减小;而苯溶液中加少量苯,稀释过程,平衡将向分子数增大方向移动,但c(HA)会减小,故A错误;
B、升高温度,HA的电离是吸热,平衡常数K1变大;2HA=(HA)2放热反应,其平衡常数K2变小,故B错误;
C、若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度,完全反应生成弱酸钠盐,虽然不是中性,但可用接近的指示剂变色判断,故C正确;
D、在25℃时,若再加入一定量的HA固体,饱和溶液则水和苯中HA的起始总浓度之比仍为3:4,不饱和溶液浓度会变大,所以无法判断,故D错误;
故答案为:ABD;
(6)滴定前溶液中氢离子浓度为:0.1mol/L×0.2=0.02mol/L,溶液的pH为:-lg0.02=2-lg2=1.7,即氢氧化钠溶液体积为0时,图象中的pH为1.7;二者浓度相同,当滴入氢氧化钠溶液体积在20mL时,图象中会出现pH突变区间,所以该滴定曲线示意图为: ,
,
故答案为:
 .
.
| 6.0×10-4×(6.0×10-4) |
| 2.4×10-3 |
故答案为:1.5×10-4;
(2)由(1)可知,溶液中氢离子浓度为:c(H+)=6.0×10-4 mol?L-1,该溶液的pH=-lgc(H+)=-lg6.0×10-4=4-lg6=4-lg2-lg3=4-0.3-0.5=3.2;
水中HA的物质的量浓度为:3.0×10-3mol?L-1×0.8=2.4×10-3mol?L-1,由于以分子形式存在的HA在苯和水两种溶剂中的比例为1:1,所以苯体系中HA的浓度为2.4×10-3mol?L-1,发生转化的HA的物质的量浓度为:(4.0×10-3-2.4×10-3)mol/L=1.6×10-3mol?L-1,在苯体系中HA的转化率为:
| 1.6×10-3mol/L |
| 4.0×10-3mol/L |
故答案为:3.2;40%;
(3)在苯中反应2HA?(HA)2的平衡常数为:K=
1.6×10-3×
| ||
| (2.4×10-3)2 |
| c[(HA)2] |
| c2(HA) |
故答案为:正反应;
(4)由反应2HA?(HA)2可知,2mol反应物参加反应时生成1mol生成物,则△S<0,再由△H-T△S<0有利于该反应自发进行,且该反应在较低温度下自发进行,所以△H<0;
故答案为:<;B;
(5)A、用分液漏斗分离得到水溶液和苯溶液,若水溶液中加入少量水,浓度越小,电离程度越大,则上述平衡正移,且c(HA)减小;而苯溶液中加少量苯,稀释过程,平衡将向分子数增大方向移动,但c(HA)会减小,故A错误;
B、升高温度,HA的电离是吸热,平衡常数K1变大;2HA=(HA)2放热反应,其平衡常数K2变小,故B错误;
C、若用酸碱中和滴定的分析方法,可以测出HA的起始总浓度,完全反应生成弱酸钠盐,虽然不是中性,但可用接近的指示剂变色判断,故C正确;
D、在25℃时,若再加入一定量的HA固体,饱和溶液则水和苯中HA的起始总浓度之比仍为3:4,不饱和溶液浓度会变大,所以无法判断,故D错误;
故答案为:ABD;
(6)滴定前溶液中氢离子浓度为:0.1mol/L×0.2=0.02mol/L,溶液的pH为:-lg0.02=2-lg2=1.7,即氢氧化钠溶液体积为0时,图象中的pH为1.7;二者浓度相同,当滴入氢氧化钠溶液体积在20mL时,图象中会出现pH突变区间,所以该滴定曲线示意图为:
 ,
,故答案为:
 .
.
点评:本题考查了化学平衡的计算、反应热和焓变、中和滴定及滴定曲线等知识,题目难度较大,注意掌握根据化学平衡进行的计算方法,明确自发反应条件与焓变和熵变的关系,能够根据题中滴定数据画出滴定曲线.

练习册系列答案
相关题目
下列各组离子在水溶液中能大量共存并且溶液为无色透明的离子组是( )
| A、K+、HCO3-、CO32-、Br- |
| B、CO32-、HCO3-、OH-、K+ |
| C、Fe3+、Cu2+、NO3-、SO42- |
| D、H+、Cl-、Na+、SO32- |
下列溶液中一定可以大量共存的离子组是( )
| A、pH为2的溶液中:K+、Mg2+、I-、ClO- |
| B、Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- |
| C、(NH4)2Fe(SO4)2?6H2O溶液中:Na+、Cu2+、Cl-、H+ |
| D、NaH2PO4的溶液中:NH4+、K+、HS-、CO32- |


 ,关于它的下列说法正确的是
,关于它的下列说法正确的是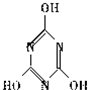 ).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是
).三聚氰酸可看成是三分子氰酸通过加成反应得到的环状分子,则氰酸的结构式是