题目内容
2.25℃时,在10mL浓度均为0.1mol/L NaOH和NH3•H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )| A. | 未加盐酸时,c (Na+)+c(OH-)=c(NH3•H2O) | |
| B. | 加入10mL盐酸时,c(NH4+)+c(H+)=c(OH-) | |
| C. | 加入盐酸至溶液pH=7时:c(Cl-)=c (Na+) | |
| D. | 加入20mL盐酸时,c(Cl-)=c(NH4+)+c (Na+) |
分析 25℃时,在10mL浓度均为0.1mol/L NaOH和NH3•H2O混合溶液中,滴加0.1mol/L的盐酸,氢氧化钠为强碱,在水溶液中完全电离,一水合氨为弱碱,在水溶液中部分电离,相同体积与浓度的氢氧化钠与一水合氨其中和能力是相同的,据此分析解答即可.
解答 解:A、NaOH和NH3•H2O混合溶液中,NaOH完全电离,NH3•H2O部分电离,由物料守恒可知c (Na+)=c(NH3•H2O)+c(NH4+),所以c(Na+)+c(OH-)>c(NH3•H2O),故A错误;
B、在此混合溶液中加入10mL盐酸,存在电中性原则:c(NH4+)+c(H+)+c(Na+)=c(OH-)+c(Cl-),由于等体积等浓度混合,故c(Na+)=c(Cl-),即c(NH4+)+c(H+)=c(OH-),故B正确;
C、加入盐酸至pH=7时,溶液呈中性,即c(H+)=c(OH-),那么c(NH4+)+c(Na+)=c(Cl-),即c(Cl-)>c(Na+),故C错误;
D、加入20mL盐酸时,此时溶液恰好为氯化钠与氯化铵的混合溶液,此时溶液呈酸性,即存在c(H+)>c(OH-),那么c(NH4+)+c(Na+)<c(Cl-),故D错误;
故选B.
点评 本题考查了酸碱混合的定性判断及溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合后溶液酸碱性的判断方法,明确电荷守恒、物料守恒的含义,能够根据溶液中守恒关系判断各离子浓度大小,试题培养了学生的灵活应用能力.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
12.短周期元素X、Y、Z、W、Q的原子序数依次增大,且只有一种金属元素.其中X与W处于同一主族,Z元素原子半径在短周期中最大(稀有气体除外).W、Z之间与W、Q之间原子序数之差相等,五种元素原子最外层电子数之和为21,下列说法正确的是( )
| A. | Y的简单气态氢化物在一定条件下可被Q单质氧化 | |
| B. | Y的简单离子半径小于Z的简单离子半径 | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
17.表示0.1mol/LNaHCO3溶液中有关微粒浓度的关系式中正确的是( )
| A. | c (Na+)>c (HCO3-)>c (CO32-)>c(H+)>c(OH-) | |
| B. | c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) | |
| C. | c (Na+)=c (HCO3-) | |
| D. | c (Na+)+c(H+)=c (HCO3-)+2c (CO32-)+c(OH-)+c(H2CO3) |
7.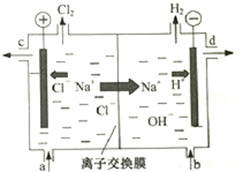 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
完成下列填空:
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)精制饱和食盐水从图中a位置补充,氢氧化钠溶液从图中d位置流出.(选填“a”、“b”、“c”或“d”)
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质.写出该反应的化学方程式2KClO3+H2C2O4+2H2SO4=2ClO2+2CO2+2KHSO4+2H2O.
(4)已知室温下几种弱酸的平衡常数:
则0.1mol/L NaClO溶液的pH>0.1mol/L Na2SO3溶液的pH.(选填“大于”、“小于”或“等于”).浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3- 浓度从大到小的顺序为c(SO32-)>c(CO32-)c(HCO3-)>c(HSO3-).
 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品.如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过.完成下列填空:
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)精制饱和食盐水从图中a位置补充,氢氧化钠溶液从图中d位置流出.(选填“a”、“b”、“c”或“d”)
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质.写出该反应的化学方程式2KClO3+H2C2O4+2H2SO4=2ClO2+2CO2+2KHSO4+2H2O.
(4)已知室温下几种弱酸的平衡常数:
| K1 | K2 | |
| H2SO3 | 1.54x 10-2 | 1.02x 10-7 |
| HClO | 2.95x 10-8 | |
| H2CO3 | 4.3x 10-7 | 5.6x 10-11 |
14.下表是元素周期表的一部分,回答下列问题:
(1)写出①、③两种元素形成的化合物有两种,其化学式分别为:CO,CO2.
(2)写出①元素最高价氧化物的电子式和结构式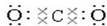 ,O=C=O.
,O=C=O.
(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)序号④⑤⑪的元素组成的化合物为NaClO,写出电子式 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出①元素最高价氧化物的电子式和结构式
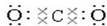 ,O=C=O.
,O=C=O.(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)序号④⑤⑪的元素组成的化合物为NaClO,写出电子式
 .
.  ;
; ;
;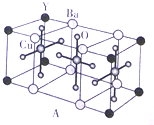 NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题:
NH3称为叠氮酸,常温下为无色有刺激性气味的液体,N${\;}_{3}^{-}$也被称为类卤离子,用酸与叠氮化钠反应可制得叠氮酸,而叠氮化钠可从下列反应制得:NaNH2+N2O═NaN3+H2O,HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,溶解铜生成CuCl${\;}_{2}^{-}$.铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶泡如图,图中小黑球代表氧原子,其余大求为Y、Cu、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症,试回答下列问题: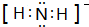 其中心原子的杂化类型是sp3
其中心原子的杂化类型是sp3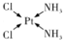 .
. ,由2个原子组成的分子是HF、阴离子是OH-.
,由2个原子组成的分子是HF、阴离子是OH-.