��Ŀ����
12����ˮ�Ȼ����ǰ�ɫ���壬������ˮ�֣���178�����������Ȼ�������Ϊ�л��ϳɺ�ʯ��ҵ�Ĵ����������ڴ������͵ȣ���ҵ���ɽ��������������û�����ˮ�Ȼ������������ڽ��������ö��Ƶã�ij������ȤС����ʵ�����ͨ��ͼ 9-30װ����ȡ������������ˮ�Ȼ�����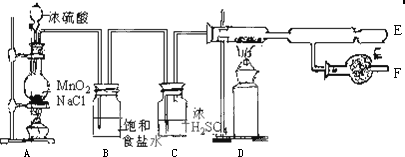
��1����ʼʵ��ʱ�������ȵ�ȼAװ�õľƾ��ƣ����Һ©���Ļ�����������Ũ����ע����ƿ��������Ƿ�ֹ��ƿ���Ȳ��������ѣ�
��2��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪH2SO4��Ũ���ᣩ+2NaCl$\frac{\underline{\;\;��\;\;}}{\;}$Na2SO4+2HCl��4HCl��Ũ���ᣩ+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$Cl2��+MnCl2+2H2O��
��3����E�����ռ����������Ȼ�������ԭ�������ɵ�AlCl3������������E������������
��4����Aװ�õ�����������������B��Cװ�ö�ֱ�ӽ���D�ܣ�����ʵ����������ĺ����δ����ȥ��HCl���塢ˮ������Cl2һͬ����D�ܣ�������Ӧ����H2������H2��Cl2��ϱ�ը��H2O������ʹAlCl3��ˮˮ���ը�ȣ�
��5��Fװ����������������ն����������������Ⱦ��������������ã���ֹ������ˮ��������D�ܣ�ʹ���ɵ�AlCl3�ܳ���
��6����ˮ�Ȼ����ڳ�ʪ�����У������������������Ӧ����ʽAlCl3+3H2O=Al��OH��3+3HCl����
���� �ڼ��������£�Ũ������Ȼ��Ʒ�Ӧ����HCl��Ũ����Ͷ��������ڼ�������������Cl2��Ũ������лӷ��ԣ��������ɵ�Cl2�к���HCl��HCl��������ˮ�����͵�NaCl��Һ�����������ܽ⣬����B�������dz�ȥ�����е�HCl��Ϊ��ֹ�Ȼ����ڳ�ʪ�Ŀ����б�ը����Cװ�ø����������ڼ��������£�Al��������Ӧ����AlCl3�����ɵ��Ȼ�����E����ȴ�õ������Ȼ�����FĿ���Ǹ����������ֹ�Ȼ���Ҳˮ������϶���ը��
��1�������ƿ���Ȳ�����ը�ѣ�
��2��Aװ���з�������Ũ������Ȼ��Ƶķ�Ӧ��Ũ����Ͷ������̵ķ�Ӧ��
��3����ˮ�Ȼ����ǰ�ɫ���壬��178��������
��4��װ����ˮ�Ȼ������Լ�ƿ���ó�ʪ�����У����Զ���ը�����������������Ҽ���������������������Ӧ��������ը��
��5��Fװ��������δ��Ӧ����������Ҳ�ܸ��������
��6����ˮ�Ȼ����ڳ�ʪ�����У����������������˵���Ȼ���ˮ����������������HCl��
��� �⣺�ڼ��������£�Ũ������Ȼ��Ʒ�Ӧ����HCl��Ũ����Ͷ��������ڼ�������������Cl2��Ũ������лӷ��ԣ��������ɵ�Cl2�к���HCl��HCl��������ˮ�����͵�NaCl��Һ�����������ܽ⣬����B�������dz�ȥ�����е�HCl��Ϊ��ֹ�Ȼ����ڳ�ʪ�Ŀ����б�ը����Cװ�ø����������ڼ��������£�Al��������Ӧ����AlCl3�����ɵ��Ȼ�����E����ȴ�õ������Ȼ�����FĿ���Ǹ����������ֹ�Ȼ���Ҳˮ������϶���ը��
��1�������ƿ���Ȳ�����ը�ѣ�Ϊ��ֹ��ƿը�ѣ����Բ��ܲ����ȵ�ȼAװ�õľƾ��ƣ����Һ©���Ļ�����������Ũ����ע����ƿ��ʴ�Ϊ����ֹ��ƿ���Ȳ��������ѣ�
��2��Aװ���з�������Ũ������Ȼ��Ƶķ�Ӧ��Ũ����Ͷ������̵ķ�Ӧ����Ӧ����ʽΪH2SO4��Ũ���ᣩ+2NaCl$\frac{\underline{\;\;��\;\;}}{\;}$Na2SO4+2HCl��4HCl��Ũ���ᣩ+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$Cl2��+MnCl2+2H2O��
�ʴ�Ϊ��H2SO4��Ũ���ᣩ+2NaCl$\frac{\underline{\;\;��\;\;}}{\;}$Na2SO4+2HCl��4HCl��Ũ���ᣩ+MnO2$\frac{\underline{\;\;��\;\;}}{\;}$Cl2��+MnCl2+2H2O��
��3����ˮ�Ȼ����ǰ�ɫ���壬��178������������D�����ɵ��Ȼ���������������E����ȴ�õ��Ȼ������壬�ʴ�Ϊ�����ɵ�AlCl3������������E������������
��4��װ����ˮ�Ȼ������Լ�ƿ���ó�ʪ�����У����Զ���ը�����������������Ҽ���������������������Ӧ��������ը�����������Aװ�õ�����������������B��Cװ�ö�ֱ�ӽ���D�ܣ�����ʵ����������ĺ����δ����ȥ��HCl���塢ˮ������Cl2һͬ����D�ܣ�������Ӧ����H2������H2��Cl2��ϱ�ը��H2O������ʹAlCl3��ˮˮ���ը�ȣ�
�ʴ�Ϊ��δ����ȥ��HCl���塢ˮ������Cl2һͬ����D�ܣ�������Ӧ����H2������H2��Cl2��ϱ�ը��H2O������ʹAlCl3��ˮˮ���ը�ȣ�
��5��Fװ��������δ��Ӧ����������ֹ��Ⱦ��������Ҳ�ܸ����������ֹ������ˮ��������D�ܣ�ʹ���ɵ�AlCl3�ܳ���
�ʴ�Ϊ�����ն����������������Ⱦ��������������ã���ֹ������ˮ��������D�ܣ�ʹ���ɵ�AlCl3�ܳ���
��6����ˮ�Ȼ����ڳ�ʪ�����У����������������˵���Ȼ���ˮ����������������HCl����Ӧ����ʽΪAlCl3+3H2O=Al��OH��3+3HCl�����ʴ�Ϊ��AlCl3+3H2O=Al��OH��3+3HCl����
���� ���⿼���Ʊ�ʵ�鷽����ƣ�Ϊ��Ƶ���㣬���ؿ���ѧ����ȡ��Ϣ����ѧ��������ȷ��ȡ��Ϣ�˽��Ȼ��������ص㼰ʵ��������������ǽⱾ��ؼ���֪������װ�����ã���Ŀ�Ѷ��еȣ�

| A�� | �����������Ӧ���ʼӿ죬ƽ�ⳣ��Ҳ����֮�仯 | |
| B�� | ����D��������ѧƽ�������ƶ� | |
| C�� | ����A������B��ת������� | |
| D�� | ƽ�ⳣ���ı���ʽΪK=$\frac{c��C��•c��D��}{c��A��^{2}•c��B��}$ |
| T/�� | 25 | 80 | 230 |
| K | 5��104 | 1 | 2��10-5 |
��1�������¶ȣ�Ni��ת���ʼ�С���������С�����䡱����
��2���ڱ����¶Ȳ��������£�Ҫ���������Ӧ��Ni��ת���ʣ��ɲ�ȡ��һ�ִ�ʩ������ѹǿ���¶Ȼ�����һ����̼��Ũ�ȣ�
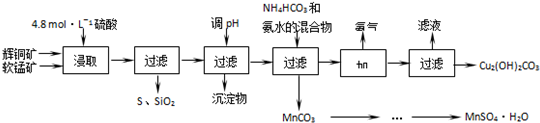
��֪����MnO2�ܽ����������е�������Ϊ������[Cu��NH3��4]SO4�����ȶ�������ˮ�л�ֽ�����NH3���۲��ֽ������������������������ ��pH��Χ���±���ʾ
| ��ʼ������pH | ������ȫ��pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
��2�����ʱ���õ��Ľ���Һ����Ҫ����CuSO4��MnSO4�ȣ�д���÷�Ӧ�Ļ�ѧ����ʽ2MnO2+Cu2S+4H2SO4=S+2CuSO4+2MnSO4+4H2O��
��3�����ڽ���ҺpH�ķ�ΧΪ3.2��PH��4.4����Ŀ����ʹFe3+����ת��Ϊ��������������ȥ��
��4���������п�ѭ��ʹ�õ�������NH3��д��ѧʽ����
��5���ñ�BaCl2��Һ�ⶨ��Ʒ��MnSO4•H2O��������ʱ��������Ʒ���ȴ���100%���ⶨ�����в��������ɺ��ԣ��������ԭ���л������������ʻ־���ʧȥ�ᾧˮ����дһ�֣���

 ������ʽ��C10H12��������Ϊ��ɫҺ�壬�д̼�����ζ���е�207�棬������ˮ����һ���������ܼ�������Һ�巢����Ӧ��C10H12+4Br2��C10H8Br4+4HBr�����ɵ����廯��������Ϊ��̬��������ˮ�����������⻯����Һ�塢����ˮ�ʹ�����Ϊԭ�ϣ��Ʊ�����������������Һ��ʵ�鲽�����£�
������ʽ��C10H12��������Ϊ��ɫҺ�壬�д̼�����ζ���е�207�棬������ˮ����һ���������ܼ�������Һ�巢����Ӧ��C10H12+4Br2��C10H8Br4+4HBr�����ɵ����廯��������Ϊ��̬��������ˮ�����������⻯����Һ�塢����ˮ�ʹ�����Ϊԭ�ϣ��Ʊ�����������������Һ��ʵ�鲽�����£�
 CH3OH��һ����ɫ�д̼�����ζ��Һ�壬����������������Ҫ��;��ͬʱҲ��һ����Ҫ�Ļ���ԭ�ϣ�
CH3OH��һ����ɫ�д̼�����ζ��Һ�壬����������������Ҫ��;��ͬʱҲ��һ����Ҫ�Ļ���ԭ�ϣ�