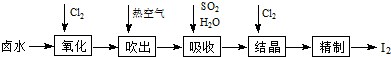
题目内容
9.2011年11月,“神舟八号”在酒泉发射升空,并取得圆满成功.“神舟八号”的运载火箭所用燃料是偏二甲肼(C2H8N2)(其中N的化合价为-3)和四氧化二氮(N2O4).在火箭升空过程中,燃料发生反应:C2H8N2+2N2O4→2CO2+3N2+4H2O提供能量.下列有关叙述正确的是( )| A. | 该燃料绿色环保,在燃烧过程中不会造成任何环境污染 | |
| B. | 该反应中N2O4是氧化剂,偏二甲肼是还原剂 | |
| C. | N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物 | |
| D. | 每有0.6 mol N2生成,转移电子数目为2.4NA |
分析 C2H8N2中C元素化合价为-1价,N为-3价,N2O4中N元素化合价为+4价,反应C2H8N2+2N2O4→2CO2+3N2+4H2O中,C元素化合价由-1价升高到+4价,N元素化合价分别由-3价、+4价变为0价,以此解答该题.
解答 解:A.四氧化二氮可污染环境,故A错误;
B.C2H8N2中C元素化合价由-1价升高到+4价,N元素化合价由-3价升高到0价,偏二甲肼是还原剂,故B正确;
C.C元素化合价升高,则CO2为氧化产物,故C错误;
D.由方程式可知,每有0.6mol N2生成,则消耗0.4molN2O4,则转移电子的物质的量为0.4mol×4×2=3.2mol,则每有0.6mol N2生成,转移电子数目为3.2NA,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意元素化合价的判断,为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
19. 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
 用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )
用0.1mol•L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入的NaOH溶液体积变化如图.下列说法不正确的是( )| A. | NaX溶液呈碱性 | B. | P点:c(Na+)>c(H+) | ||
| C. | M点:c(HX)+c(X-)=2c(Na+) | D. | M点水电离程度小于N点 |
17.无色而有刺激性气味的甲酸,是最简单的羧酸液体,熔点8.6℃,沸点100.8℃.化学实验室常用甲酸(HCOOH)和浓硫酸混合加热制备一氧化碳,其反应方程式为:HCOOH$\frac{\underline{\;H_{2}SO_{4}\;}}{△}$CO↑+H2O,制备时先加热浓硫酸至80℃-90℃,控制温度,再逐滴滴入甲酸.

(1)请从上图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置.现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水.将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写).
证明有一氧化碳生成的现象是E中氧化铜粉末变红,E后B装置中澄清石灰水变浑浊.
(2)实验室可用甲酸制备甲酸铜.其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体.查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇.
相关的化学方程式是:2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:



①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是研细并混合均匀.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到有黑色固体生成(填写实验现象),说明温度过高.
Ⅱ、甲酸铜的制备:将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的$\frac{1}{3}$时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品.
③制取甲酸铜时需要“趁热过滤”的原因是防止甲酸铜晶体析出.
④用无水乙醇洗涤晶体的目的是减少晶体的损耗以及洗去晶体表面的水和其它杂质.

(1)请从上图中选用所需的仪器(仪器可重复使用)组成一套验证甲酸(HCOOH)和浓硫酸加热生成产物的实验装置.现提供以下药品:甲酸、浓硫酸、无水硫酸铜、氧化铜粉末、澄清石灰水.将所用仪器的序号按连接顺序由上至下依次填入下表(可以不填满),并写出该仪器中应加试剂的名称或化学式(划横线部分不需要填写).
| 选用的仪器 | 加入的试剂 |
| A | 甲酸、浓硫酸 |
| D | -- |
(2)实验室可用甲酸制备甲酸铜.其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体.查阅资料可知四水甲酸铜晶体为浅蓝色晶体,可溶于水,难溶于醇.
相关的化学方程式是:2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:



①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是研细并混合均匀.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃-80℃,如果看到有黑色固体生成(填写实验现象),说明温度过高.
Ⅱ、甲酸铜的制备:将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的$\frac{1}{3}$时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品.
③制取甲酸铜时需要“趁热过滤”的原因是防止甲酸铜晶体析出.
④用无水乙醇洗涤晶体的目的是减少晶体的损耗以及洗去晶体表面的水和其它杂质.
14.向饱和澄清石灰水中加入生石灰,再恢复到原温度,下列说法正确的是( )
| A. | Ca2+浓度减小 | B. | 溶剂质量减小 | C. | 溶液质量不变 | D. | Ca2+数目增多 |
1.下列用来表示物质变化的化学用语中,错误的是( )
| A. | 钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
18.反应4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol/L.对此反应速率的正确表示是( )
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用B、C、D分别表示反应的速率,其比值是3:2:1 | |
| C. | 在2min末的反应速率用B表示是0.3 mol/(L•min) | |
| D. | 在这2min内用B和C表示的速率的值都是逐渐增大的 |
 Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.
Ba 2+(aq)+SO4 2-(aq)△H=+40KJ/mol.