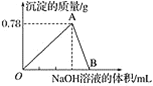
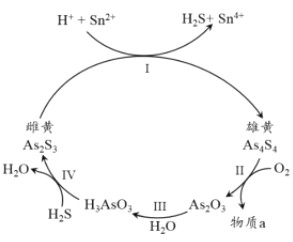
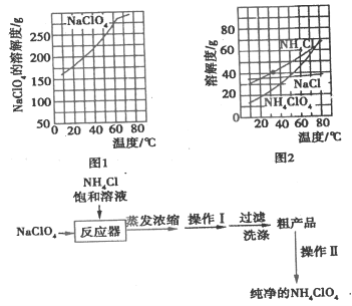
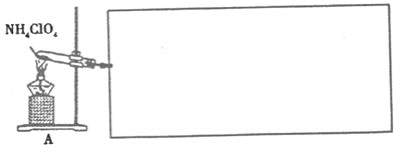
题目内容
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下其流程图如下:
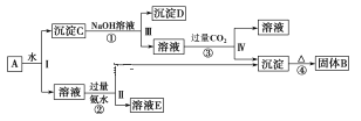
(1)写出下列B、D所含物质的化学式:固体B____; 沉淀D_____。
(2)进行操作Ⅰ、Ⅱ、Ⅲ、Ⅳ所用到的玻璃仪器为___________________;
(3)写出②、③的反应离子方程式:
②_____________________________________________。
③___________________________________________________________________
(4)KAl(SO4)2净水的原因是_____________________________。(用离子方程式和必要的文字解释)
【答案】Al2O3 Fe2O3 玻璃棒、漏斗、烧杯 Al3++3NH3·H2O = Al(OH)3↓+3NH4+ AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- Al3++3H2O![]() Al(OH)3胶体+3H+,生成Al(OH)3胶体能够吸附水中的悬浮物达到净水
Al(OH)3胶体+3H+,生成Al(OH)3胶体能够吸附水中的悬浮物达到净水
【解析】
由流程图可知,由于KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后过滤,溶液中的溶质是KAl(SO4)2,沉淀C是Al2O3和Fe2O3;向沉淀C中加NaOH溶液,Fe2O3不反应,两性氧化物Al2O3可与NaOH溶液反应生成NaAlO2,则沉淀C为Fe2O3,溶液中的溶质为NaAlO2,向NaAlO2溶液中通入过量二氧化碳,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,则过滤得到沉淀为Al(OH)3,滤液为碳酸氢钠溶液;向KAl(SO4)2溶液中加过量氨水,反应生成Al(OH)3沉淀、硫酸铵和硫酸钾;将反应生成的氢氧化铝加热分解得到Al2O3,则固体B为Al2O3。
(1)由分析可知,固体B为Al2O3,沉淀D为Fe2O3,故答案为:Al2O3;Fe2O3;
(2)由流程图可知,操作Ⅰ、Ⅱ、Ⅲ、Ⅳ均为过滤,过滤所用到的玻璃仪器为玻璃棒、漏斗、烧杯,故答案为:玻璃棒、漏斗、烧杯;
(3)反应②为KAl(SO4)2溶液与过量氨水反应生成Al(OH)3沉淀、硫酸铵和硫酸钾,反应的离子方程式为Al3++3NH3·H2O = Al(OH)3↓+3NH4+;反应③为偏铝酸钠溶液与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为,故答案为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+;AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(4)KAl(SO4)2净水的原因是KAl(SO4)2电离出的Al3+在溶液中水解生成Al(OH)3胶体,生成的Al(OH)3胶体具有很大的表面积,能够吸附水中的悬浮物达到净水的目的,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+,生成Al(OH)3胶体能够吸附水中的悬浮物达到净水。
Al(OH)3(胶体)+3H+,生成Al(OH)3胶体能够吸附水中的悬浮物达到净水。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案