题目内容
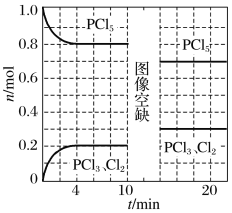
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
【答案】A
【解析】
A. 0~4 min的平均速率v(PCl3)=![]() =0.025 mol·L-1·min-1,故A正确;
=0.025 mol·L-1·min-1,故A正确;
B.由图可知,改变条件使PCl3(g)、Cl2(g)的物质的量增大,平衡正向移动,则10min时改变的条件是升温,故B错误;
C.从图中读出起始时向该容器中充入1.0mol PCl3和1.0molCl2,保持温度为T,转化率为1-20%=80%,若起始时向该容器中充入2.0mol PCl3和2.0molCl2,保持温度为T,相当于加压,故转化率大于80%,反应达平衡时放出的热量大于1.6akJ,故C错误;
D.起始时向该容器中充入1.0mol PCl5、0.10mol PCl3和0.10molCl2,Qc=![]() =0.005,结合图可知K=
=0.005,结合图可知K=![]() =
=![]() >Qc,反应正向进行,v正>v逆,故D错误;
>Qc,反应正向进行,v正>v逆,故D错误;
故选A。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45 倍。 | (1)A的相对分子质量为:_____________。 |
(2)将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______________。 |
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 | (3)用结构简式表示A 中含有的官能团__________。 |
(4)A的核做共振氢谱如下图:
| (4)A中含有四种氢原子。 |
(5)综上所述,A 的结构简式为__________, 写出两分子A能脱去两分子水形成一种六元环状化合物的化学方程式_______________________________________ (6)A有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1molH2,则该种同分异构体的结构简式为 ____________。 | |