题目内容
4.x、y、z、e、f、g是原子序数依次增大的六种短周期元素,x与另外五种元素均可形成二元化合物,其中x、y形成最简单的有机物M是重要的清洁能源.金属元素e的单质在常温下能与水剧烈反应,z元素原子的L层电子数为K层电子数的三倍,z、f、g三种元素原子的最外层电子数之和为19.请回答下列问题:(1)g在元素周期表的位置是第三周期第VIIA族.
(2)yzf分子中所有原子的最外层都满足8电子结构,其电子式为
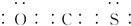 .
.(3)元素h与e处于同周期,且形成的简单离子是本周期中半径最小的.h的单质与Fe2O3反应时,每消耗0.5mol h放热213kJ,写出该反应的热化学方程式2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-852kJ•mol-1.
(4)仅由z、e、f三种元素形成的一种六核离子化合物,溶于水后呈碱性,请用一个离子方程式表示其呈减性的原因SO32-+H2O
 HSO3-+OH-;溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
HSO3-+OH-;溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).(5)g元素能形成多种离子,在水溶液中lmolg-、gzn-(n=l,2,3,4:不同离子在图中用A、B、D、W、Q表示)的能量(kJ)相对大小如图所示.
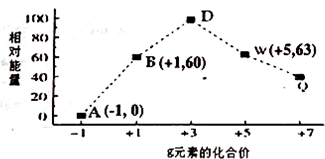
A、B、D、W、Q五种离子中性质最稳定的是Cl-(写具体的离子符号),一定条件下D能转化为A与W,写出此转化的离子方程式3ClO2-=Cl-+2ClO3-.
分析 x、y形成最简单的有机物M是重要的清洁能源,则M为CH4,可知x为H元素,y为C元素,金属元素e的单质在常温下能与水剧烈反应,应为Na,z元素原子的L层电子数为K层电子数的三倍,为O元素,z、f、g三种元素原子的最外层电子数之和为19,则f、g的原子的最外层电子数之和为13,应分别为S、Cl元素,以此解答该题.
解答 解:x、y形成最简单的有机物M是重要的清洁能源,则M为CH4,可知x为H元素,y为C元素,金属元素e的单质在常温下能与水剧烈反应,应为Na,z元素原子的L层电子数为K层电子数的三倍,为O元素,z、f、g三种元素原子的最外层电子数之和为19,则f、g的原子的最外层电子数之和为13,应分别为S、Cl元素,
(1)由以上分析可知g为Cl元素,位于周期表第三周期第 VIIA族,故答案为:第三周期第 VIIA族;
(2)yzf分子中所有原子的最外层都满足8电子结构,形成的化合物为CSO,具有二氧化碳的结构特点,电子式为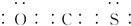 ,
,
故答案: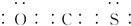 ;
;
(3)元素h与e处于同周期,且形成的简单离子是本周期中半径最小的,应为Al.Al单质与Fe2O3反应时,每消耗0.5molAl放热213kJ,则消耗2molAl放热852kJ,该反应的热化学方程式为2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-852kJ•mol-1,
故答案为:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)△H=-852kJ•mol-1;
(4)仅由z、e、f三种元素形成的一种六核离子化合物为Na2SO3,为强碱若酸盐,溶于水后呈碱性,离子方程式为SO32-+H2O HSO3-+OH-,以第一步水解为主,溶液中离子浓度大小顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
HSO3-+OH-,以第一步水解为主,溶液中离子浓度大小顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:SO32-+H2O HSO3-+OH-;c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
HSO3-+OH-;c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(5)能量越低,离子越稳定,则最稳定的为Cl-,由化合价可知A为Cl-,B为ClO-,D为ClO2-,W为ClO3-,则D转化为A与W的离子方程式为3ClO2-=Cl-+2ClO3-,
故答案为:Cl-;3ClO2-=Cl-+2ClO3-.
点评 本题考查位置结构性质关系综合应用,为高考常见题型,推断元素是解题关键,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

 阅读快车系列答案
阅读快车系列答案
| A. | 左边装置是氢氧燃料电池,右边装置是电镀池 | |
| B. | 电子流动方向:b→Zn→CuSO4(aq)→Cu→a | |
| C. | 一段时间后,左端溶液浓度变小,右端溶液浓度不变 | |
| D. | 左边装置中的电池反应为:2H2+O2=2H2O |
| A. | 3-甲基-2-乙基戊烷 | |
| B. | (CH3)3CCH2CH(C2H5)CH3 2,2-二甲基-4-乙基戊烷 | |
| C. | 2-甲基-3-戊炔 | |
| D. | 邻甲基苯酚 |
| A. | CH3CH2CH(CH3)CH(CH3)OH:3-甲基-2-戊醇 | |
| B. | CH3CH(CH3)CH═CH2:3-甲基丁烯 | |
| C. | CH3CH2C(CH3)2CH3:2,2-甲基丁烷 | |
| D. | CH2Cl-CH2Cl:二氯乙烷 |
| A. | 难氧化,易加成,难取代 | |
| B. | 能氧化,难加成,易取代 | |
| C. | 易氧化,易加成,难取代 | |
| D. | 因是单双键交替结构,故易加成为环己烷 |

| A. | 氢化物的沸点R>X | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的稳定性:X>Y | |
| D. | X、Z形成的化合物中可能含有共价键 |
 冶炼铁都需要用到的原料是石灰石
冶炼铁都需要用到的原料是石灰石