题目内容
(1)配平下列离子反应方程式:
(2)在标准状况下生成2.24LNO时,转移电子物质的量为
3
3
Cu2S+22
22
HNO3--6
6
Cu(NO3)2+3
3
H2SO4+10
10
NO+8
8
H2O(2)在标准状况下生成2.24LNO时,转移电子物质的量为
0.3mol
0.3mol
.分析:(1)根据电子转移守恒、原子守恒配平.
(2)N元素由+5价降为+2价,一个N原子得3个电子.
(2)N元素由+5价降为+2价,一个N原子得3个电子.
解答:解:(1)Cu化合价从+1变为+2,S化合价从-2变为+6;N化合价从+5变为+2
则化合价升高=1×2+8=10
化合价降低=5-2=3
化合价升降最小公倍数为30,所以Cu2S的系数为3,NO系数为10,再根据原子守恒观察配平其它物质的系数,所以
3Cu2S+22HNO3═6Cu(NO3)2+3H2SO4+10NO+8H2O
故答案为:3;22;6;3;10;8
(2)转移电子物质的量
×3=0.3mol.
故答案为:0.3mol
则化合价升高=1×2+8=10
化合价降低=5-2=3
化合价升降最小公倍数为30,所以Cu2S的系数为3,NO系数为10,再根据原子守恒观察配平其它物质的系数,所以
3Cu2S+22HNO3═6Cu(NO3)2+3H2SO4+10NO+8H2O
故答案为:3;22;6;3;10;8
(2)转移电子物质的量
| 2.24L |
| 22.4L/mol |
故答案为:0.3mol
点评:考查氧化还原反应配平、计算,难度中等,配平注意Cu2S只做还原剂,HNO3做氧化剂的同时还起酸的作用,将不同元素升高化合价合并计算.

练习册系列答案
相关题目
 +______,
+______,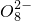 +H2O→Mn
+H2O→Mn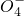 +S
+S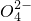 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol. +______,
+______, +H2O→Mn
+H2O→Mn +S
+S +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.