题目内容
18.下列实验事实不能用勒夏特列原理解释的是( )| A. |  | |||||||||
| B. |
| |||||||||
| C. |  | |||||||||
| D. |
|
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A、金属铝和盐酸的反应不是可逆反应,不能用化学平衡移动原理来解释,故A选;
B、碘化氢的分解反应属于吸热反应,升高温度,平衡正向移动,K增加,所以能用化学平衡移动原理来解释,故B不选;
C、二氧化氮转化为四氧化二氮的反应是放热的,温度降低,逆向移动,颜色变浅,能用化学平衡移动原理来解释,故C不选;
D、增大压强可以使合成氨的反应正向移动,反应物的转化率增大,能用化学平衡移动原理来解释,故D不选.
故选A.
点评 本题考查了化学平衡移动原理的分析判断,影响因素的分析,平衡移动原理的理解是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.如图是元素周期表的一部分,氮元素所在的位置是( )


| A. | ① | B. | ② | C. | ③ | D. | ④ |
9.对于A2(g)+3B2(g)═2C(g)的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=0.4mol/(L•s) | ||
| C. | v(B2)=90.0mol/(L•min) | D. | v(C)=36mol/(L•min) |
6.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 100 mL 0.1 mol•L-1稀硫酸中含有硫酸根个数为0.1NA | |
| B. | 常温下,1.12 L氮气所含原子数为0.1NA | |
| C. | 1 mol Na2O2与足量的盐酸反应,转移电子数为2NA | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
13.下列叙述正确的是( )
| A. | 同温同压下,相同体积的物质,它们的物质的量一定相等 | |
| B. | 任何条件下,等质量的一氧化二氮(N2O)和二氧化碳所含的分子数必相等 | |
| C. | 1 L一氧化碳的质量一定比1 L氧气质量小 | |
| D. | 等体积、等物质的量浓度的盐酸和硫酸中所含的H+数一定相等 |
3.某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常教的数值,则下列说法中正确的是( )
①该原子的相对原子质量为$\frac{12a}{b}$
②mg该原子的物质的量为$\frac{m}{a{N}_{A}}$mol
③该硫原子的摩尔质量是aNAg/mol
④ag该硫原子所含的电子数为16
⑤cg 该硫原子所含质子数为$\frac{4bc{N}_{a}}{3A}$.
①该原子的相对原子质量为$\frac{12a}{b}$
②mg该原子的物质的量为$\frac{m}{a{N}_{A}}$mol
③该硫原子的摩尔质量是aNAg/mol
④ag该硫原子所含的电子数为16
⑤cg 该硫原子所含质子数为$\frac{4bc{N}_{a}}{3A}$.
| A. | ①②③④⑤ | B. | ①②③④ | C. | ①②④⑤ | D. | ①③④⑤ |
10.下列说法不正确的是( )
| A. | ${\;}_{6}^{14}$C表示质子数为6、中子数为8的核素 | |
| B. | 甲醇(CH3OH)和甘油( 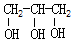 )互为同系物 )互为同系物 | |
| C. | C5H12的同分异构体有3种,其沸点各不相同 | |
| D. | CH3CH2CH2CH(CH3)2的名称是2-甲基戊烷' |
7.若20g密度为ρ g•cm-3的Ca(NO3)2(相对分子质量为164)溶液中含有1g Ca(NO3)2,则溶液中NO3-的物质的量浓度为( )
| A. | $\frac{100ρ}{41}$ mol•L-1 | B. | $\frac{20}{ρ}$ mol•L-1 | C. | $\frac{50ρ}{41}$ mol•L-1 | D. | $\frac{25ρ}{41}$ mol•L-1 |
8.下列说法不正确的是( )
| A. | 甲烷与乙烷互为同系物 | |
| B. | H2和D2互为同位素 | |
| C. | 正丁烷与异丁烷互为同分异构体 | |
| D. | CHFCl2曾用作制冷剂,其分子结构只有一种 |