题目内容
A、B、C、D是原子序数依次增大的四种短周期元素,他们分别按原子个数1:1组成甲、乙、丙、丁四种物质,已知:甲由A、B组成,常温为气态;乙由A、C组成,常温为液态;丙由A、D组成,丁为C、D组成,丙丁均为离子化合物.
根据以上信息回答:
(1)D在周期表处于第 周期 族;乙的电子式: ;丙的化学式 ;
(2)丁遇水易变质,请用化学方程式解释.
(3)标准状况下,5.6L甲完全燃烧生成稳定氧化物放出325KJ热,则甲燃烧热的热化学方程式为: .
根据以上信息回答:
(1)D在周期表处于第
(2)丁遇水易变质,请用化学方程式解释.
(3)标准状况下,5.6L甲完全燃烧生成稳定氧化物放出325KJ热,则甲燃烧热的热化学方程式为:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:原子序数依次递增的两种短周期元素按照1:1组合的化合物有:双氧水、乙炔、苯、过氧化钠、氟化氢、氯化氢、氯化钠、NaH等,据此分析所含有的元素,应分别位于第ⅠA族,第ⅣA族,第ⅥA族,第ⅤⅡA族,然后依据原子序数依次增大,且甲乙丙丁的组成验证即可,推断得出A为氢,B为碳,C为氧,D为钠.
解答:
解:A、B、C、D是原子序数依次增大的四种短周期元素,他们分别按原子个数1:1组成甲、乙、丙、丁四种物质,已知:甲由A、B组成,常温为气态,故可能为乙炔;乙由A、C组成,常温为液态,可能为双氧水;丙由A、D组成,可能为NaH,丁为C、D组成,可能为过氧化钠,丙丁均为离子化合物,验证符合题意,故A为氢,B为碳,C为氧,D为钠,
(1)Na处于第三周期第ⅠA族,乙为双氧水,电子式为: ,丙为NaH,故答案为:三;ⅠA族;
,丙为NaH,故答案为:三;ⅠA族; ;NaH;
;NaH;
(2)过氧化钠与水反应生成氢氧化钠和氧气,化学反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)5.6g乙炔的物质的量为:
=0.25mol,此时放出热量为325kJ,故1mol乙炔(22.4L)放出热量为:
=1300kJ,故热化学反应方程式为:C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol,故答案为:C2H2(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol.
(1)Na处于第三周期第ⅠA族,乙为双氧水,电子式为:
 ,丙为NaH,故答案为:三;ⅠA族;
,丙为NaH,故答案为:三;ⅠA族; ;NaH;
;NaH;(2)过氧化钠与水反应生成氢氧化钠和氧气,化学反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)5.6g乙炔的物质的量为:
| 5.6L |
| 22.4L/mol |
| 325 |
| 0.25 |
| 5 |
| 2 |
| 5 |
| 2 |
点评:本题主要考查的是元素的推断以及元素化合物的知识,涉及热化学反应热计算与热化学反应方程式书写,难度较大.

练习册系列答案
相关题目
X、Y、Z、W有如如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y不可能是( )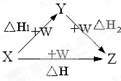

| A、C、CO |
| B、AlCl3、Al(OH)3 |
| C、Fe、Fe(NO3)2 |
| D、S、SO3 |
某烃A与Br2发生加成反应生成二溴代物B.B用热的NaOH醇溶液处理得有机物C,经测定C的分子中含有两个双键,其分子式为C5H6.将C在催化条件下加氢可得到分子式为C5H10的有机物D,D的一氯代物只有1种结构.则烃A的结构简式为( )
| A、CH3CH2CH2CH═CH2 |
| B、CH2═CH-CH2-CH═CH2 |
C、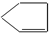 |
D、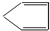 |
 某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42-,CO32-等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是( )
某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42-,CO32-等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列判断正确的是( )| A、原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+ |
| B、原溶液中含Fe3+和Al3+,物质的量之比为l:l |
| C、原溶液中可能含有CO32- |
| D、反应最后形成的溶液中含有的溶质只有NaAlO2 |
某物质灼烧时,焰色反应为黄色,下列判断中错误的是( )
| A、该物质可能是金属钠 |
| B、该物质一定含钠元素 |
| C、该物质中可能含钾元素 |
| D、该物质一定是钠的化合物 |
下列关于钠及其化合物的叙述中,正确的是( )
| A、一小块钠长期露置在空气中,最终变成NaOH固体 |
| B、氯化钠是一种性质稳定的化合物,可用作调味品,灼烧时火焰呈无色 |
| C、过氧化钠有很强的还原性,可作为潜水艇中的供氧剂 |
| D、向苯和水的混合体系中加入钠,钠块会在分界面上下不停跳动 |
下列说法正确的是( )
| A、金属在反应中只能作还原剂,非金属在反应中只能作氧化剂 |
| B、氧化剂在反应中失去电子,还原剂在反应中得到电子 |
| C、氧化剂具有氧化性,还原剂具有还原性 |
| D、阳离子只有氧化性,阴离子只有还原性 |
下列离子方程式正确的是( )
| A、Na2O2 溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| B、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、在硫酸溶液中加入氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、FeSO4溶液中加入用H2SO4酸化的H2O2溶液:2Fe2++2H++H2O2=2 Fe3++2H2O |