题目内容
1.2016年11月4日是《巴黎协定》气候协议生效的日期,其宗旨是提高绿色低碳转型的竞争力、抵御气候变化,人们需要用不同的方法将CO2进行转化利用.(1)处理CO2的方法之一是使其与氢气反应合成甲醇.已知氢气、甲醇燃烧的热化学方程式如下:
2H2(g)+O2(g)═2H2O(I)△H=-283.0kJ•mol-1
2CH3OH(I)+3O2(g)═2CO2(g)+4H2O{I)△H=-726.0kJ•mol-1
写出二氧化碳与氢气合成甲醇液体的热化学方程式CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5kJ/mol;
(2)CO2经催化加氢还可合成低碳烯烃:
2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H=Q kJ•mol-1
在0.1MPa时,按n(CO2):n(H2)=1:3投料,图1表示平衡时四种气态物质的物质的(n)与温度(T)的关系.
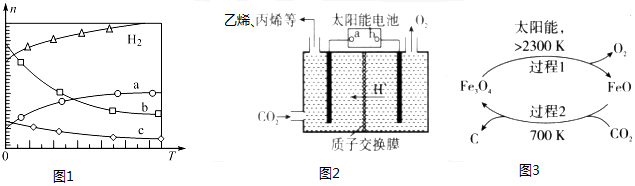
(1)Q<0(填“>”、或“<”);
②曲线b表示的物质为b.
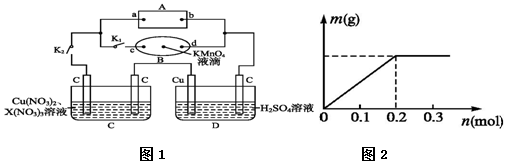
(3)在强酸性的电解质水溶液中,用惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示.
①该工艺中能量转化方式主要有太阳能转化为电能,电能转化为化学能;
②电解时,生成丙烯的电极反应式为3CO2+18H++18e-=C3H6+6H2O.
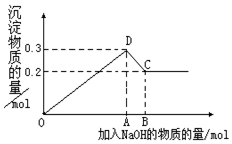
(4)以CO2为原料制取碳(C)的太阳能工艺如图3所示.
①过程1中发生反应的化学方程式为2Fe3O4 $\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑.
②过程2中每生成lmolFe3O4[FeO•Fe2O3]转移电子的物质的量为2mol.
分析 (1)由①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol;
根据盖斯定律:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=$\frac{3①-②}{2}$,进行计算求解;
(2)由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;可知a为CO2的变化曲线,结合计量数关系可知b为水,c为C2H4的变化曲线;
(3)太阳能电池为电源,电解强酸性的二氧化碳水溶液得到丙烯,丙烯在阴极生成;
(4)①由示意图可知,过程1中四氧化三铁在大于2300K条件下分解生成氧化亚铁和碳;
②反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,结合元素化合价以及方程式计算.
解答 解:(1)由①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol;
根据盖斯定律:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=$\frac{3①-②}{2}$=$\frac{3×(-283.0)-(-726.0)}{2}$=-61.5 kJ/mol,
故答案为:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5 kJ/mol;
(2)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,Q<0,
故答案为:<;
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线,
故答案为:H2O;
(3)①太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,可知能量转化形式有光能转化为电能,电能转化为化学能,部分电能转化为热能,
故答案为:太阳能转化为电能,电能转化为化学能;
②电解时,二氧化碳在b极上生成丙烯,得到电子的一极为电源的正极,电极反应式为:3CO2+18H++18e-=C3H6+6H2O,
故答案为:3CO2+18H++18e-=C3H6+6H2O;
(4)①由示意图可知,过程1中四氧化三铁在大于2300K条件下分解生成氧化亚铁和碳,反应的化学方程式为:2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑,
故答案为:2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑;
②反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2molFe3O4参加反应,生成1mol氧气,转移4mol电子,则每分解lmolFe3O4转移电子的物质的量为2mol,
故答案为:2mol.
点评 本题涉及热化学方程式书写和盖斯定律计算、氧化还原、化学平衡移动以及原电池反应等知识,考查了学生分析问题、解决问题的能力,题目难度中等.

 优学名师名题系列答案
优学名师名题系列答案| A. | FeCl3 | B. | Na2CO3 | C. | KAl(SO4)2•12H2O | D. | CuSO4 |
| A. | 用碱式滴定管量取16.00 mL KMnO4溶液 | |
| B. | 用乙醇萃取水溶液中的溴单质 | |
| C. | 用托盘天平称取5.6 g食盐 | |
| D. | 用标准盐酸滴定未知浓度的NaOH溶液消耗盐酸的体积为21.5 mL |
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
| A. | 胶头滴管伸入量筒内滴加液体 | |
| B. | 用酒精灯的外焰给盛有液体(液体体积约占试管体积的$\frac{1}{4}$)的试管加热 | |
| C. | 称量完药品后,将药匙内剩余的药品放回试剂瓶 | |
| D. | 过滤时漏斗的末端在烧杯的中央 |
| A. | O2 | B. | N2 | C. | F2 | D. | Cl2 |
 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则: 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1