题目内容
拟用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂). 能够制备的是( )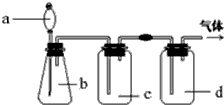

| 气体 | a | b | c | d | |
| A | SO2 | Na2SO3粉末 | 硫酸 | 浓硫酸 | NaOH溶液 |
| B | HCl | 浓盐酸 | 浓硫酸 | 浓硫酸 | 盐酸 |
| C | NH3 | 浓氨水 | 消石灰 | 浓硫酸 | 水 |
| D | Cl2 | 浓盐酸 | MnO2 | 饱和氯化钠溶液 | 浓H2SO4 |
| A、A | B、B | C、C | D、D |
考点:常见气体制备原理及装置选择,气体的净化和干燥
专题:实验题
分析:根据气体和洗气装置中的溶液、干燥剂能否反应判断能得到的气体.
A.二氧化硫为酸性氧化物能够与D中氢氧化钠反应;
B.氯化氢易溶于水,通入盛有盐酸的D中,氯化氢被吸收;
C.氨气为碱性气体,不能用浓硫酸干燥;
D.浓盐酸与二氧化锰在加热条件下反应生成的氯气中含有氯化氢和水,通入到饱和食盐水,氯化氢被吸收,通过浓硫酸,水被吸收.
A.二氧化硫为酸性氧化物能够与D中氢氧化钠反应;
B.氯化氢易溶于水,通入盛有盐酸的D中,氯化氢被吸收;
C.氨气为碱性气体,不能用浓硫酸干燥;
D.浓盐酸与二氧化锰在加热条件下反应生成的氯气中含有氯化氢和水,通入到饱和食盐水,氯化氢被吸收,通过浓硫酸,水被吸收.
解答:
解:A.二氧化硫为酸性氧化物能够与D中氢氧化钠反应,得不到二氧化硫气体,故A错误;
B.氯化氢易溶于水,通入盛有盐酸的D中,氯化氢被吸收,得不到氯化氢气体,故B错误;
C.氨气为碱性气体,不能用浓硫酸干燥,故C错误;
D.浓盐酸与二氧化锰在加热条件下反应生成的氯气中含有氯化氢和水,通入到饱和食盐水除去氯化氢,通过浓硫酸除去水,得到干燥、纯净的氯气,故D正确;
故选:D.
B.氯化氢易溶于水,通入盛有盐酸的D中,氯化氢被吸收,得不到氯化氢气体,故B错误;
C.氨气为碱性气体,不能用浓硫酸干燥,故C错误;
D.浓盐酸与二氧化锰在加热条件下反应生成的氯气中含有氯化氢和水,通入到饱和食盐水除去氯化氢,通过浓硫酸除去水,得到干燥、纯净的氯气,故D正确;
故选:D.
点评:本题考查了气体的制备、净化,明确制备气体的反应原理和气体的性质是解题关键,难度不大.

练习册系列答案
相关题目
铁丝在氯气中燃烧的主要产物是FeCl3而不是FeCl2,这并非因为( )
| A、氯气的氧化性很强 |
| B、氯原子的得电子能力很强 |
| C、氯气毒性很强 |
| D、氯气是很活泼的非金属 |
在下列溶液中,Cl-物质的量浓度相同的是( )
| A、1L 0.2 mol/L A1C13溶液 |
| B、100ml 0.3 mol/L MgCl2溶液 |
| C、0.5L 0.1 mol/L NaCl溶液 |
| D、1L 0.3 mol/L HC1溶液 |
某500mL溶液中含0.2molFe2+、0.4molFe3+,加入0.4molFe,待反应完全后,溶液中亚铁离子的物质的量浓度为( )
| A、0.8mol/L |
| B、1.2mol/L |
| C、1.6mol/L |
| D、2.0mol/L |
对已达到化学平衡的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,说法正确的是( )
| A、升高温度,正、逆反应速率都增大,平衡向逆方向移动 |
| B、减少压强,逆反应速率增大,正反应速率减少,平衡向逆方向移动 |
| C、移去部分SO3,正反应速率增大,逆反应速率减少,平衡向正方向移动 |
| D、加入催化剂,正、逆反应速率都增大,平衡常数不变 |
在10L密闭容器中,1mol A和3mol B在一定条件下反应:A(g)+xB(g)?2C(g),2min后达到平衡,生成0.4mol C,测得混合气体共3.4mol,则下列结果正确的是( )
| A、平衡时,物质的量之比n(A):n(B):n(C)=2:11:4 |
| B、x值等于3 |
| C、A的转化率为20% |
| D、B的平均反应速率为0.4 mol/(L?min) |


 (R1、R2、R3为烃基或氢原子)
(R1、R2、R3为烃基或氢原子)