题目内容
FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S.
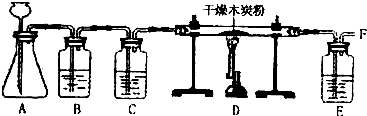
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性:
②通入干燥的Cl2,赶尽装置中的空气;
⑨用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为 .
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是 .
(3)操作步骤中,为防止FeCl3潮解所采取的措施有 (填步骤序号)
(4)装置B中冷水浴的作用为 装置C的名称为 .
(5)在虚线框中画出尾气吸收装置E并注明试剂.
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
(6)FeCl3与H2S反应的离子方程式为 .
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:①H2S的原子利用率为100%;② .
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性:
②通入干燥的Cl2,赶尽装置中的空气;
⑨用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是
(3)操作步骤中,为防止FeCl3潮解所采取的措施有
(4)装置B中冷水浴的作用为
(5)在虚线框中画出尾气吸收装置E并注明试剂.
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
(6)FeCl3与H2S反应的离子方程式为
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:①H2S的原子利用率为100%;②
考点:性质实验方案的设计,制备实验方案的设计
专题:实验设计题
分析:(1)装置A中铁与氯气反应生成氯化铁;
(2)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质;
(3)防止FeCl3潮解,不与水蒸气接触;
(4)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管;
(5)用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸;
(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应;
(7)电解氯化亚铁时,阴极阳离子得到电子发生还原反应;阳极阳离子失去电子发生氧化反应;
(8)根据FeCl3可以循环利用.
(2)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质;
(3)防止FeCl3潮解,不与水蒸气接触;
(4)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管;
(5)用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸;
(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应;
(7)电解氯化亚铁时,阴极阳离子得到电子发生还原反应;阳极阳离子失去电子发生氧化反应;
(8)根据FeCl3可以循环利用.
解答:
解:(1)装置A中铁与氯气反应生成氯化铁,反应为2Fe+3Cl2
2FeCl3,故答案为:2Fe+3Cl2
2FeCl3;
(2)对FeCl3加热发生升华使沉积的FeCl3进入收集器,故答案为:在沉积的FeCl3固体下方加热;
(3)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2⑤用干燥的N2赶尽Cl2,故选:②⑤
(4)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品,装置C的名称为干燥管,故答案为:冷却,使FeCl3沉积,便于收集产品;干燥管;
(5)用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,故答案为: ;
;
(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应:2FeCl3+H2S=2FeCl2+2HCl+S↓,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
(7)电解氯化亚铁时,阴极发生氢离子得电子的还原反应,2H++2e-═H 2↑,阳极亚铁离子发生失电子的氧化反应:Fe2+-e-=Fe3+,故答案为:Fe2+-e-=Fe3+;
(8)FeCl3得到循环利用,故答案为:FeCl3得到循环利用.
| ||
| ||
(2)对FeCl3加热发生升华使沉积的FeCl3进入收集器,故答案为:在沉积的FeCl3固体下方加热;
(3)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2⑤用干燥的N2赶尽Cl2,故选:②⑤
(4)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品,装置C的名称为干燥管,故答案为:冷却,使FeCl3沉积,便于收集产品;干燥管;
(5)用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,故答案为:
 ;
;(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应:2FeCl3+H2S=2FeCl2+2HCl+S↓,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
(7)电解氯化亚铁时,阴极发生氢离子得电子的还原反应,2H++2e-═H 2↑,阳极亚铁离子发生失电子的氧化反应:Fe2+-e-=Fe3+,故答案为:Fe2+-e-=Fe3+;
(8)FeCl3得到循环利用,故答案为:FeCl3得到循环利用.
点评:本题是一道综合题,考查了学生运用知识解决问题的能力,涉及到的知识点较多,综合性强,难度大.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
有①②③三瓶体积相等,浓度都是1mol?L-1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体,(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液体积是( )
| A、①=③>② |
| B、③>②>① |
| C、③=②>① |
| D、①=②=③ |
配制一定物质的量浓度的溶液时,下列做法会使配得的溶液浓度偏高的是( )
| A、容量瓶中含有少量蒸馏水 |
| B、将溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
| C、定容时观察液面俯视 |
| D、定容时倒转容量瓶几次,发现凹液面最低点低于标线,再补几滴水到标线 |