题目内容
8.已知3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,当19.2g铜参加反应,试计算:(1)参加反应的硝酸的物质的量?
(2)被还原的硝酸的质量?
分析 反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,3molCu完全反应消耗8mol硝酸,其中做氧化剂被还原的硝酸为2mol,据此进行计算.
解答 解:(1)19.2gCu的物质的量为:$\frac{19.2g}{64g/mol}$=0.3mol,
根据反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O可知,
0.3molCu完全反应消耗硝酸的物质的量为:0.3mol×$\frac{8}{3}$=0.8mol,
答:参加反应的硝酸的物质的量为0.8mol;
(2)反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中被还原的稀释生成NO,则被还原的硝酸的物质的量为:0.8mol×$\frac{2}{8}$=0.2mol,
答:反应中被还原的硝酸为0.2mol.
点评 本题考查了化学方程式的计算,题目难度不大,明确氧化还原反应的实质为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
18.如图是模拟铁的电化学防护装置.以下叙述正确的是( )
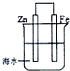

| A. | 此装置属于电解池 | |
| B. | 此装置中的铁做正极,发生氧化反应 | |
| C. | 此装置中电子从锌极流向铁极 | |
| D. | 此装置中的锌做阴极,极反应为:Zn-2e→Zn2+ |
19.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18gNH4+中含有的电子数为11NA | |
| B. | 12g石墨中含有的共价键数为1.5NA | |
| C. | 标准状况下,22.4LNO2和CO2混合物中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成 Na2O和Na2O2的混合物,钠失去NA个电子 |
13. 一种植物生长调节的结构简式如图所示,下列说法不正确的是( )
一种植物生长调节的结构简式如图所示,下列说法不正确的是( )
 一种植物生长调节的结构简式如图所示,下列说法不正确的是( )
一种植物生长调节的结构简式如图所示,下列说法不正确的是( )| A. | 该物质含有3种官能团 | B. | 该物质属于脂环烃 | ||
| C. | 该物质属于多官能团化合物 | D. | 该物质属于烃的衍生物 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.8 g 重水(D2O)中含有的中子数为NA | |
| B. | 常温常压下,22.4 L O2 含有的分子数为NA | |
| C. | 1 L 1 mol/L FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 0.1 mol CO2分子中含有的共用电子对的数目是0.4 NA |
17.下列描述的一定是金属元索的是( )
| A. | 原子核内有4个质子的元素 | B. | 能与水反应的单质 | ||
| C. | 原子的最外层只有2个电子的元素 | D. | 能形成离子化合物的元素 |
16.将W1g光亮的铜丝在空气中加热一段时间后,迅速插入下列物质中,取出干燥,如此反复几次,最后取出铜丝用蒸馏水洗涤、干燥,称得其质量为W2 g.实验时由于所插入的物质不同,铜丝的前后质量变化可能不同,下列所插物质与铜丝的质量关系正确的是( )
| A. | 石灰水,W1=W2 | B. | 乙醇溶液,W1=W2 | C. | NaHSO4,W1<W2 | D. | CO,W1>W2 |