题目内容
铅蓄电池充电时,PbSO4( )
| A、在阳极生成 |
| B、在阴极生成 |
| C、在两个电极上生成 |
| D、在两个电极上除去 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:铅蓄电池充电,实质是电解反应,阳极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,阴极发生反应为:PbSO4=Pb-2e-+SO42-,据此分析.
解答:
解:铅蓄电池放电时,负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++SO42-=PbSO4+2H2O,充电是放电的逆反应,阳极上发生反应为:PbSO4+2H2O-2e-=PbO2+4H++2SO42-,阴极发生反应为:PbSO4=Pb-2e-+SO42-,
故选D.
故选D.
点评:本题考查铅蓄电池充电过程中的物质变化,熟悉其电极反应式即可,题目难度不大.

练习册系列答案
相关题目
某化学反应经过2min,生成物Y的浓度从0增加到0.24mol/L,而反应物X的浓度从0.3mol/L变成0.22mol/L.该反应可能是( )
| A、X+2Z→3Y |
| B、X+Z→2Y |
| C、3X→Y+Z |
| D、X→Y+3Z |
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g)?xC(g)+2D(g).
5min时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L?min).下列说法正确的是( )
3A(g)+B(g)?xC(g)+2D(g).
5min时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1mol/(L?min).下列说法正确的是( )
| A、起始A的物质的量为2mol |
| B、5min时B的转化率为16.67% |
| C、5min时A的浓度为1.5 mol/L |
| D、x=3 |
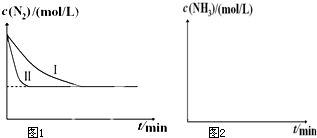 (1)已知:N2(g)+O2(g)═2NO(g)△H1
(1)已知:N2(g)+O2(g)═2NO(g)△H1
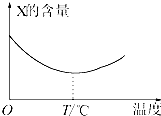 两种气态单质X和Y能直接化合生成Z(可逆反应),如将X和Y按一定比例混合并压入密闭容器中,在不同温度下经过一段时间后,反应混合物中X的含量变化如图所示,回答下列问题:
两种气态单质X和Y能直接化合生成Z(可逆反应),如将X和Y按一定比例混合并压入密闭容器中,在不同温度下经过一段时间后,反应混合物中X的含量变化如图所示,回答下列问题: